Resistência de nematoides gastrintestinais de caprinos e ovinos aos anti-helmínticos levamisol, ivermectina e albendazol
DOI:
https://doi.org/10.1590/1809-6891v24e-75316EResumo
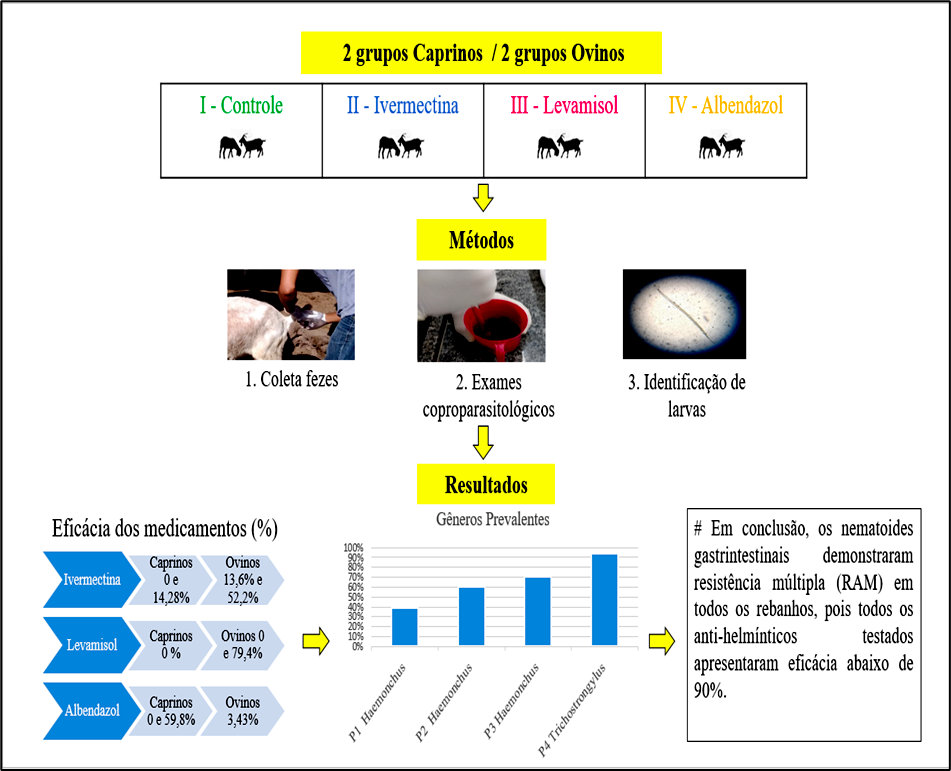
Objetivou-se determinar a resistência de nematoides gastrintestinais aos anti-helmínticos levamisol, ivermectina e albendazol em caprinos e ovinos da região metropolitana da Ilha de São Luís, Maranhão, Brasil. Foram coletadas amostras de fezes de 150 animais de quatro propriedades diferentes, sendo 2 com caprinos e 2 com ovinos, e aleatoriamente distribuídos de três a quatro grupos de 10 animais: Grupo I: grupo controle, sem tratamento. Grupo II: tratado com anti-helmíntico à base de ivermectina, administrado oralmente na dose de 200 mcg/kg; Grupo III: tratado com anti-helmíntico à base de levamisol, administrado oralmente na dose de 7,5mg/kg e Grupo IV: tratado com anti-helmíntico à base de albendazol administrado oralmente na dose de 3mg/kg. Amostras de fezes foram colhidas da ampola retal um dia antes do tratamento e 10 dias após o tratamento anti-helmíntico. Foram feitos exames coproparasitológicos individuais, pela técnica de McMaster modificada, no Laboratório de Sanidade Animal, do Instituto Federal do Maranhão (IFMA), Campus São Luís-Maracanã. A ivermectina, na espécie caprina, mostrou eficácia de 14,28%, enquanto para ovina, 13,6 e 52,2%. Considerando o levamisol na espécie caprina, não apresentou eficácia contra os nematoides gastrintestinais, enquanto para ovinos, apresentou eficácia de 79,4%. Já o albendazol, apresentou eficácia de 59,8% para caprinos, e 3,43% para ovinos. Os nematoides gastrintestinais demonstraram resistência múltipla (RAM), visto que a percentagem de redução da contagem de ovos foi inferior a 95% e o limite inferior do intervalo de confiança menor do que 90%.
Palavras-chave: antiparasitários; resistência anti-helmíntica; pequenos ruminantes
Downloads
Referências
Afonso VAC, Costa RLD, Soares FCV, Cunha EAD, Perri SHV, BONELLO FL. Supplementation with protected fat to manage gastro-intestinal nematode infection in Santa Ines sheep. Semina: Ciências Agrárias. 2013;34(3):1227-1238. (http://dx.doi.org/10.5433/1679-0359.2013v34n3p1227)
Bath GF, Hansen JW, Krecek RC, Van Wyk JA, Vatta AF. Sustainable approaches for managing haemonchosis in sheep and goats. FAO (Technical Cooperation Project No TCP/SAF/8821A), FAO. [Internet].2001; 89p. Disponível em: https://agris.fao.org/agris-search/search.do?recordID=XF2007425673
Besier RB. Refugia-based strategies for sustainable worm control: factors affecting the acceptability to sheep and goat owners. Vet Parasitol. 2012 May 4;186(1-2):2-9. Disponível em: doi: 10.1016/j.vetpar.2011.11.057
Borges SL, Oliveira AA, Mendonça LR, Lambert SM, Viana JM, Nishi SM, Julião FS, Almeida MAO. Resistência anti-helmíntica em rebanhos caprinos nos biomas Caatinga e Mata Atlântica. Pesq. Vet. Bras. [Internet].2015;35(7):643-648. Disponível em: http://dx.doi.org/10.1590/S0100-736X2015000700007.
Bressani FA, Tizioto PC, Giglioti R, Meirelles SL, Coutinho R, Benvenuti CL, Malagó W Jr, Mudadu MA, Vieira LS, Zaros LG, Carrilho E, Regitano LC. Single nucleotide polymorphisms in candidate genes associated with gastrointestinal nematode infection in goats. Genet Mol Res. [Internet].2014;20;13(4):8530-6. Disponível em: http://dx.doi.org/10.4238/2014.20.outubro.29
Brito DRB, Santos ACG, Teixeira WC, Guerra RMSN de C. Parasitos gastrintestinais em caprinos e ovinos da microrregião do Alto Mearim e Grajaú, Estado do Maranhão. Ciênc. anim. bras. [Internet].2009;10(3):967-74. Disponível em: https://revistas.ufg.br/vet/article/view/5444
Coles GC , Bauer C , Borgsteede FH , Geerts S , Klei TR , Taylor MA , & Waller PJ. World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) Methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet Parasito. [Internet].1992;44, 35-44. Disponível em: http://dx.doi.org/10.1016/0304-4017(92)90141-U
de Castro EMS, Souza EAR, Dantas ACS, da Silva IWG, Medeiros de Araújo M, Santos de Azevedo S, Sangioni LA, Horta MC. resistência parasitária de nematódeos gastrintestinais de caprinos criados em região semiárida de Pernambuco, nordeste do brasil. Revista veterinária e zootecnia. [Internet]. 2021;28:1-12. Disponível em: https://rvz.emnuvens.com.br/rvz/article/view/523
Fernandes MAM, Gilaverte S, Buzatti A, Sprenger LK, Silva CJA, Peres MTP, Molento MB, Monteiro A.L.G. Método famacha para detectar anemia clínica causada por Haemonchus contortus em cordeiros lactentes e ovelhas em lactação. Pesquisa Veterinária Brasileira [Internet]. 2015;35(6): 525-530. Disponível em http://dx.doi.org/10.1590/S0100-736X2015000600006
Fernandes MAM, Salgado JA, Peres MTP, Campos KFD, Molento MB, Monteiro A LG. Can the strategies for endoparasite control affect the productivity of lamb production systems on pastures?. Revista Brasileira De Zootecnia. [Internet]. 2019;48. Disponível em: e20180270. https://doi.org/10.1590/rbz4820180270
Geary TG. Institute of Parasitology, McGill University, Canada. [Internet].2013. Disponível em: https://www.mcgill.ca/parasitology/faculty/geary/publications
Georgi JR, Georgi ME. Parasitology for veterinarians. [Internet].1990;412. Disponível em: https://www.elsevier.com/books/georgis-parasitology-for-veterinarians/bowman/978-0-323-54396-5
Greer AW, Van Wyk JA, Joseph CH. Refugia-based strategies for parasite control in livestock. Vet Clin Food Anim. [Internet].2020;36(1):31-43. Disponível em http://dx.doi.org/10.1016/j.cvfa.2019.11.003
IBGE, Instituto Brasileiro de Geografia e Estatística. [Internet].2020. Disponível em: https://www.ibge.gov.br/estatisticas/economicas/agricultura-e-pecuaria/9107-producao-da-pecuaria-municipal.html?=&t=destaques
Lima MM, Farias MPO, Romeiro ET, Ferreira DRA, Alves LC, Faustino MAG. Eficácia da moxidectina, ivermectina e albendazole contra Helmintos gastrintestinais em propriedades de criação caprina e ovina no estado de Pernambuco. Ci. Anim. Bras. [Internet].2010;11(1):94-100. Disponível em: Disponível em: https://revistas.ufg.br/vet/article/view/1103
Kaplan RM, Burke JM, Terril TH, Miller JE, Getz WR, Mobini S, Valencia E, Williams MJ, Williamson LH, Larsen M, Vatta AF. Validation of the FAMACHA© eye color chart for detecting clinical anemia in sheep and goats on farms in the southern United States. Veterinay Parasitology. [Internet]. 2004;123(1-2):105-120. Disponível em: https://doi.org/10.1016/j.vetpar.2004.06.005
Mahieu M, Arquet R, Kandassamy T, Mandonnet N, Hoste H. Evaluation of targeted drenching using Famacha method in Creole goat: Reduction of anthelmintic use, and effects on kid production and pasture contamination. Veterinary Parasitology. [Internet].2007;146(1-2):135-147. Disponível em: https:// doi.org/10.1016/j.vetpar.2007.02.003
Mederos AE, Ramos Z, Banchero GE. First report of monepantel Haemonchus contortus resistance on sheep farms in Uruguay. Parasites & Vectores [Internet].2014; 7(1): 598. Disponível em: http://dx.doi.org/ 10.1186/s13071-014-0598-z
Melo LRB, Vilela VLR, Feitosa TF, Almeida Neto JL, Moraes DF. Resistência anti-helmíntica em pequenos ruminantes do Semiárido da paraíba, brasil. ARS VETERINARIA. [Internet].2013;29(2):104-108.
Mickiewicz M, Czopowicz M, Kawecka-Grochocka E, Moroz A, Szaluś-Jordanow O, Várady M, Kaba J. The first report of multidrug resistance in gastrointestinal nematodes in goat population in Poland. BMC Veterinary Research. [Internet].2020; 16(1). Disponível em: https://doi.org/10.1186/s12917-020-02501-5
Molento MB, Gavião AA, Depner RA, Pires CC. Frequency of treatment and production performance using the FAMACHA method compared with preventive control in ewes. Vet Parasitol. [Internet].2009;10;162(3-4):314-9. Disponível em: https://doi.org/10.1016/j.vetpar.2009.03.031
Monteiro MG, Brisola MV, Vieira Filho JER. Diagnóstico da cadeia produtiva de caprinos e ovinos no Brasil. Instituto de Pesquisa Econômica Aplicada (Ipea). [Internet].2021. Disponível em: http://dx.doi.org/10.38116/td2660
Mottin V D, Cruz JF, Teixeira Neto MR, Marisco G, Figueredo JS, Sousa LS. Efficacy, toxicity, and lethality of plants with potential anthelmintic activity in small ruminants in Brazil. Revista Brasileira De Saúde e Produção Animal. [Internet].2019; 20. Disponível em: https://doi.org/10.1590/S1519-9940200232019
Oliveira PA, Riet-Correa B, Estima-Silva P, Coelho ACB, Santos BL, Costa MAP, Schild AL. Multiple anthelmintic resistance in Southern Brazil sheep flocks. Revista Brasileira de Parasitologia Veterinária. [Internet].2017;26(4):427–432. Disponivel em: https://doi.org/10.1590/S1984-29612017058
Reso. Faecal egg count reduction test (FECRT) Analysis Program Version 2.01. Csiro, 1989. Disponível em: https://pubmed.ncbi.nlm.nih.gov/15110408/
Riet CB, Simões SVD, Pereira FJM, Azevedo SSA, Melo DB, Batista JA, Riet CF. Sistemas produtivos de caprinocultura leiteira no semiárido paraibano: caracterização, principais limitantes e avaliação de estratégias de intervenção. Pesquisa Veterinária Brasileira. [Internet].2013;33(3):345-352. Disponível em: https://doi.org/10.1590/S0100-736X2013000300012
Rinaldi L, Cringoli G. Parasitological and pathophysiological methods for selective application of anthelmintic treatments in goats. Small Ruminant Research. [Internet]. 2012;103(1):18-22. Disponível em: https://www.sciencedirect.com/journal/small-ruminant-research/vol/103/issue/1
Roberts FHS, O’Sullivan JP. Methods for egg counts and larval cultures for strongyles infesting the gastrointestinal tract of cattle. Australian Journal Agriculture Research. [Internet].1950. 99-102p. Disponível em: https://doi.org/10.1071/AR9500099
Saddiqi HA, Jabbar A, Sarwar M, Iqbal Z, Muhammad G, Nisa M, Shahzad, A. Small ruminant resistance against gastrointestinal nematodes: a case 20 of Haemonchus contortus. Parasitology Research. [Internet].2011;109:1483–1500. Disponível em: https://doi.org/10.1007/s00436-011-2576-0
Salgado JA, Santos CP. Overview of anthelmintic resistance of gastrointestinal nematodes of small ruminants in Brazil. Revista Brasileira De Parasitologia Veterinária. [Internet].2016:25(1): 3–17. Disponível em: https://doi.org/10.1590/S1984-29612016008
Silva DG, Menezes BM, Bettencourt AF, Frantz AC, Corrêa MR, Ruszkowski G, Martins A A, Brum LP, Hirschmann L C. Método FAMACHA® como ferramenta para verificar a infestação parasitária ocasionada por Haemonchus spp. em ovinos. PUBVET. ´[Internet].2017;11:1015-1021. Disponível em: http://dx.doi.org/10.22256/pubvetv11n101015-1021
Silva FF, Bezerra HMFF, Feitosa TF, Vilela VLR. Nematode resistance to five anthelmintic classes in naturally infected sheep herds in Northeastern Brazil. Rev. Bras. Parasitologia Vet. [Internet].2018;27(4). Disponível em: https://doi.org/10.1590/S1984-296120180071
Scott I, Pomroy WE, Kenyon PR, Smith G, Adlington B, Moss A. Lack of efficacy of monepantel against Teladorsagia circumcincta and Trichostrongylus colubriformis. Veterinary Parasitology [Internet].2013;198(1-2):166-171. Disponível em: http://dx.doi.org/10.1016/j.vetpar.2013.07.037
Simone LB, Alex AO, Lívia R.M, Sabrina ML , Juliana MV , Sandra MN , Fred SJ, Maria AOA. Resistência anti-helmíntica em rebanhos caprinos nos biomas Caatinga e Mata Atlântica. Pesq. Vet. Bras. 2015;35(7):643-648. Disponível em: https://doi.org/10.1590/S0100-736X2015000700007
Sotomaior CS, Rosalinskimoraes F, Costa ARB, Maia D, Monteiro AL, Van Wyk JA. Sensitivity and specificity of the FAMACHA© system in Suffolk sheep and crossbred Boer goats. Veterinary Parasitology. [Internet].2012;190(1-2):114-119. Disponível em: https://doi.org/10.1016/j.vetpar.2012.06.006
Ueno H, Gonçalves PC. Manual para diagnóstico das helmintoses de ruminantes. JICA. [Internet].1998;143p. Disponível em: https://r1.ufrrj.br/adivaldofonseca/wp-content/uploads/2014/06/manual_helmintoses-UENO-site-do-CBPV.pdf
Van Den Brom R, Moll L, Kappert C, Vellema P. Haemonchus contortus resistance to monepantel in sheep. Veterinary Parasitology [Internet].2015;209(3-4):278-280. Disponível em: http://dx.doi.org/10.1016/j.vetpar.2015.02.026
Van Wyk JA, Bath GF. The FAMACHA system for managing haemonchosis in sheep and goats by clinically identifying individual animals for treatment. Veterinary Research. [Internet].2002;33(5):509-529. Disponível em:
https://doi.org/10.1051/vetres:2002036
Van Wyk JA. Refugia-overlooked as perhaps the most important factor concerning the development of anthelmintic resistance. The Onderstepoort Journal of Veterinary Research. [Internet].2001 Mar;68(1), 55–67.
Vatta AF, Letty BA, Van Der Linde MJ, Van Wyk EF, Hansen JW, Krecek RC. Testing for clinical anaemia caused by Haemonchus spp. in goats farmed under resource-poor conditions in South Africa using an eye colour chart developed for sheep. Veterinary Parasitology. [Internet].2001;99(1):1-14. Disponível em: https://doi.org/10.1016/s0304-4017(01)00446-0
Veríssimo CJ, Niciura SCM, Alberti ALL, Rodrigues CFC, Barbosa CMP, Chiebao DP, Molento MB. Multidrug and multispecies resistance in sheep flocks from São Paulo state, Brazil. Veterinary Parasitology. [Internet].2012;187(1-2):209–216. Disponível em: https://doi.org/10.1016/j.vetpar.2012.01.013
Downloads
Publicado
Como Citar
Edição
Seção
Licença
Copyright (c) 2023 Ciência Animal Brasileira / Brazilian Animal Science

Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.
Autores que publicam nesta revista concordam com os seguintes termos:
- Autores mantém os direitos autorais e concedem à revista o direito de primeira publicação, com o trabalho simultaneamente licenciado sob a Licença Creative Commons Attribution que permite o compartilhamento do trabalho com reconhecimento da autoria e publicação inicial nesta revista.
- Autores têm autorização para assumir contratos adicionais separadamente, para distribuição não-exclusiva da versão do trabalho publicada nesta revista (ex.: publicar em repositório institucional ou como capítulo de livro), com reconhecimento de autoria e publicação inicial nesta revista.
- Autores têm permissão e são estimulados a publicar e distribuir seu trabalho online (ex.: em repositórios institucionais ou na sua página pessoal) a qualquer ponto antes ou durante o processo editorial, já que isso pode gerar alterações produtivas, bem como aumentar o impacto e a citação do trabalho publicado (Veja O Efeito do Acesso Livre).






























