Termografia infravermelha na detecção de mastite clínica e subclínica em bovinos de leite: comparação entre as raças Girolando e Jersey
DOI:
https://doi.org/10.1590/1809-6891v24e-76726EResumo
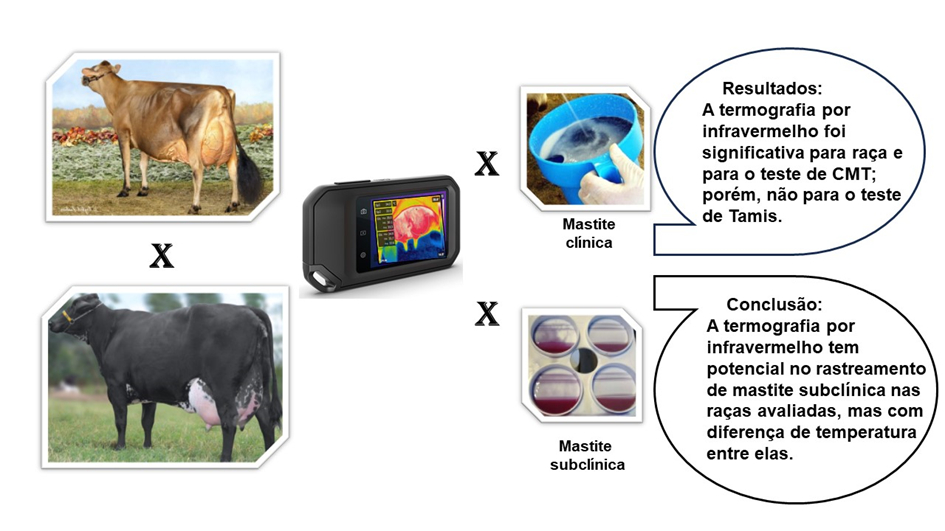
A mastite é uma das doenças mais comuns do gado leiteiro em todo o mundo, ocupando o primeiro lugar, com alta prevalência e incidência. Afeta a produção e a qualidade do leite, diminuindo o retorno econômico e a sustentabilidade da fazenda. A precocidade do diagnóstico e tratamento da mastite é de extrema importância, visando diminuir os danos, tanto para o animal quanto para o produtor e a indústria. A termografia infravermelha (TI) em animais é um método clinicamente útil para detectar alterações fisiopatológicas, por meio de variações térmicas, causadas pela inflamação. Este trabalho objetivou avaliar o potencial da técnica de TI para o diagnóstico de mastite clínica e subclínica em vacas Girolando e Jersey. Foram avaliados 78 quartos de vacas Girolando e 104 de Jersey pertencentes a propriedades rurais de Adamantina e região. As diferenças das intensidades das imagens por TI foram comparadas com as temperaturas do quarto anterior e posterior, em um único ponto central ou área, em relação aos resultados dos testes de Tamis e CMT. Todas as análises foram realizadas no Software R, sendo adotado um nível de significância igual a 5%. Quando a imagem termográfica foi avaliada, o tamanho do efeito foi significativo para raça e para o teste de CMT, porém não para o teste de Tamis. Em conclusão, a TI tem potencial no rastreamento de mastite subclínica nas raças avaliadas, com capacidade diagnóstica preditiva semelhante ao CMT, mas com diferença de temperatura entre elas, sendo equivalentes suas mensurações em ponto ou área da glândula mamária.
Palavras-chave: diagnóstico; glândula mamária; imagem térmica; inflamação.
Downloads
Referências
Santos RDL, Alessi AC. Patologia veterinária, 3ª ed. Grupo GEN; 2023. ISBN: 09788527738972.
Constable PD. Clínica veterinária - Um tratado de doenças dos bovinos, ovinos, suínos e caprinos. 11ª ed. Grupo GEN; 2020. ISBN-10: 8527736926.
Santos MV, Fonseca FL. Controle da mastite e qualidade do leite - desafios e soluções. São Paulo: Edição dos Autores; 2019. ISBN: 9788591591312.
Bortolami A, Fiore E, Gianesella M, Corro M, Catania S, Morgante M. Evaluation of the udder health status in subclinical mastitis affected dairy cows through bacteriological culture, somatic cell count and thermographic imaging. Pol J Vet Sci 2015; 18(4):799–805. https://doi.org/10.1515/pjvs-2015-0104
Berry RJ, Kennedy AD, Scott SL, Kyle BL, Schaefer AL. Daily variation in the udder surface temperature of dairy cows measured by infrared thermography: Potential for mastitis detection. Can J Anim Sci 2003; 83(4):687–93. https://doi.org/10.4141/A03-012
Colak A, Polat B, Okumus Z, Kaya M, Yanmaz LE, Hayirli A. Short Communication: Early detection of mastitis using infrared thermography in dairy cows. J Dairy Sci 2008; 91(11):4244–8. https://doi.org/10.3168/jds.2008-1258
Polat B, Colak A, Cengiz M, Yanmaz LE, Oral H, Bastan A, Kaya S, et al. Sensitivity and specificity of infrared thermography in detection of subclinical mastitis in dairy cows. J Dairy Sci 2010; 93(8):3525–32. https://doi.org/10.3168/jds.2009-2807
Sathiyabarathi M, Jeyakumar S, Manimaran A, Jayaprakash G, Pushpadass HA, Sivaram M, et al. Infrared thermography: A potential noninvasive tool to monitor udder health status in dairy cows. Vet World 2016; 9(10):1075–81. https://doi.org/10.14202/vetworld.2016.1075-1081
Zheng S, Zhou C, Jiang X, Huang J, Xu D. Progress on Infrared Imaging Technology in Animal Production: A Review. Sensors 2022; 18; 22(3):705. https://doi.org/10.3390/s22030705
Hovinen M, Siivonen J, Taponen S, Hänninen L, Pastell M, Aisla AM, et al. Detection of clinical mastitis with the help of a thermal camera. J Dairy Sci 2008; 91(12):4592–8. https://doi.org/10.3168/jds.2008-1218
Zaninelli M, Redaelli V, Luzi F, Bronzo V, Mitchell M, Dell’Orto V, et al. First evaluation of infrared thermography as a tool for the monitoring of udder health status in farms of dairy cows. Sensors 2018; 18(3):862. https://doi.org/10.3390/s18030862
Chakraborty S, Dhama K, Tiwari R, Yatoo MI, Khurana SK, Khandia R, et al. Technological interventions and advances in the diagnosis of intramammary infections in animals with emphasis on bovine population—a review. Vet Q 2019; 39(1):76–94. https://doi.org/10.1080/01652176.2019.1642546
Silva RAB, Pandorfi H, Luiz Pontes de Almeida G, Antônio de Assunção Montenegro A, da Silva MV. Spatial dependence of udder surface temperature variation in dairy cows with healthy status and mastitis. Rev Bras Saúde Prod Anim 2019; 20(1): 1-15. http://dx.doi.org/10.1590/s1519-99402001102019
Porcionato AM, Canata TF, Oliveira CEL, Santos, MV. Udder thermography of Gyr cows for subclinical mastitis detection. Rev Bras Eng Biossistemas 2009; 3(3), 251–257. https://doi.org/10.18011/bioeng2009v3n3p251-257
Velasco-Bolaños J, Ceballes-Serrano CC, Velásquez-Mejía D, Riaño-Rojas JC, Giraldo CE, Carmona JU, et al. Application of udder surface temperature by infrared thermography for diagnosis of subclinical mastitis in Holstein cows located in tropical highlands. J Dairy Sci 2021; 104(9):10310–23. https://doi.org/10.3168/jds.2020-19894
Poikalainen V, Praks J, Veermae I, Kokin E. Infrared temperature patterns of cow’s body as an indicator for health control at precision cattle farming. Agro Res Biosystem Eng 2012, 1:187-194. https://agronomy.emu.ee/vol10Spec1/p10s121.pdf
Yang C, Li G, Zhang X, Gu X. Udder skin surface temperature variation pre- and post-milking in dairy cows as determined by infrared thermography. J Dairy Res 2018; 85(2):201–3. https://doi.org/10.1017/S0022029918000213
McManus R, Boden LA, Weir W, Viora L, Barker R, Kim Y, et al. Thermography for disease detection in livestock: A scoping review. Front Vet Sci 2022. https://doi.org/10.3389/fvets.2022.965622
Neculai-Valeanu AS, Ariton AM. Udder health monitoring for prevention of bovine mastitis and improvement of milk quality. Bioeng 2022; 9(11):608. https://doi.org/10.3390/bioengineering9110608
Wang Y, Li Q, Chu M, Kang X, Liu G. Application of infrared thermography and machine learning techniques in cattle health assessments: A review. Biosyst Eng 2023; 230:361–87. https://doi.org/10.1016/j.biosystemseng.2023.05.002
Schalm OW, Noorlander DO. Experiments and observations leading to development of California Mastitis Test. J Am Vet 1957; 130(5):199-207.
Pereira C.C.J. Fundamentos de bioclimatologia aplicados à produção animal. Belo Horizonte: FEPMVZ; 2005.
Haynes W. Bonferroni Correction. In: Dubitzky W, Wolkenhauer O, Cho KH, Yokota, H (eds) Encyclopedia of systems biology. New York: Springer; 2013. https://doi.org/10.1007/978-1-4419-9863-7_1213
Box GEP; Cox DR. An analysis of transformations. J Royal Soc 1964; 26(2):211-252.
Tomczak M, Tomczak E. The need to report effect size estimates revisited. An overview of some recommended measures of effect size. Trends Sport Sci 2014; 1(21):19-25.
R Core Team (2020). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/
Downloads
Publicado
Como Citar
Edição
Seção
Licença
Copyright (c) 2023 Ciência Animal Brasileira / Brazilian Animal Science

Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.
Autores que publicam nesta revista concordam com os seguintes termos:
- Autores mantém os direitos autorais e concedem à revista o direito de primeira publicação, com o trabalho simultaneamente licenciado sob a Licença Creative Commons Attribution que permite o compartilhamento do trabalho com reconhecimento da autoria e publicação inicial nesta revista.
- Autores têm autorização para assumir contratos adicionais separadamente, para distribuição não-exclusiva da versão do trabalho publicada nesta revista (ex.: publicar em repositório institucional ou como capítulo de livro), com reconhecimento de autoria e publicação inicial nesta revista.
- Autores têm permissão e são estimulados a publicar e distribuir seu trabalho online (ex.: em repositórios institucionais ou na sua página pessoal) a qualquer ponto antes ou durante o processo editorial, já que isso pode gerar alterações produtivas, bem como aumentar o impacto e a citação do trabalho publicado (Veja O Efeito do Acesso Livre).






























