Avaliação de células mesenquimais e dapsona para o tratamento de feridas dermonecróticas causadas pelo veneno de Loxosceles laeta em coelhos
DOI:
https://doi.org/10.1590/1809-6891v23e-72573EResumo
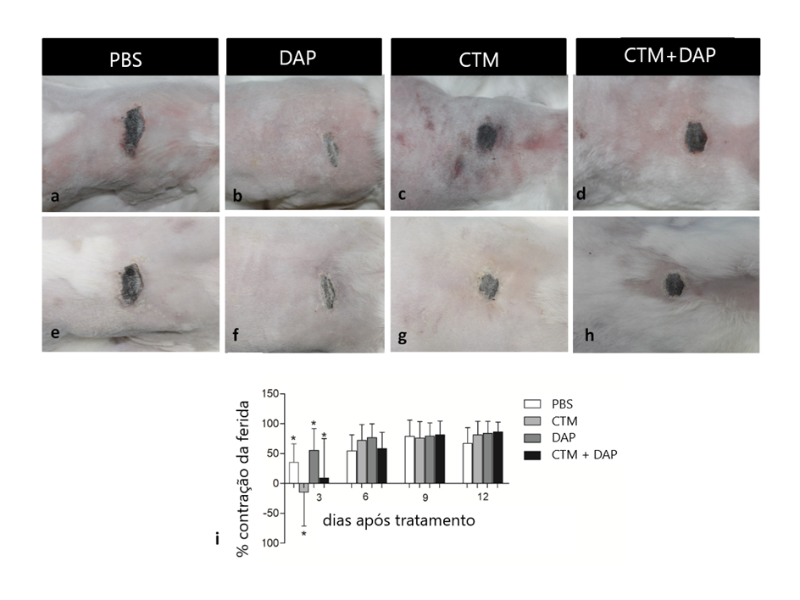
Este estudo teve como objetivo avaliar a eficácia das células-tronco mesenquimais (CTMs), isoladas ou associadas à dapsona (DAP), no tratamento de feridas dermonecróticas causadas pelo veneno de Loxosceles laeta. Vinte e cinco coelhos machos foram distribuídos em cinco grupos. O controle negativo recebeu água ultrapura (C-), enquanto todos os outros grupos foram injetados com 20 μg de veneno de L. laeta. Após 4 horas, cada grupo recebeu um dos seguintes tratamentos: PBS (C+), DAP, CTMs e DAP + CTMs. Os animais foram avaliados diariamente durante 12 dias, e feitos registros fotográficos para análise da ferida e no 12º dia, foram eutanasiados e, retiradas amostras de pele para análise histológica. Observou-se que a DAP apresentou o melhor percentual de contração da ferida no terceiro dia. Nos tratamentos com CTMs, observou-se uma contração negativa da ferida tanto para as CTMs isoladas, bem como a associação CTMs + DAP em relação ao PBS, possivelmente, pelo aumento da inflamação inicial após a aplicação de células-tronco. Isso é devido ao fato de que as CTMs secretam um amplo espectro de moléculas bioativas como citocinas e fatores de crescimento que favorecem a regeneração. Histologicamente, observou-se que os animais de C+ apresentaram extensas áreas de necrose, úlceras, infiltrado neutrofílico, além de mineralização. Houve aumento de deposição de colágeno no tratamento CTMs + DAP, no entanto, a vascularização permaneceu inalterada. Este é o primeiro relato usando CTMs e CTMs + DAP como tratamento para loxoscelismo cutâneo e mais estudos são necessários para determinar seu uso como terapia alternativa para lesões demonecróticas causadas pela aranha Loxosceles.
Palavras-chave: loxoscelismo; células-tronco; CTMs; veneno de aranha; reparo de feridas.
Downloads
Referências
Andrade RMG, Lourenço WR, Tambourgi DV. Comparison of the fertility between Loxosceles intermedia and Loxosceles laeta spiders (Araneae, Sicariidae). 2000. Journal of Arachnology. 2000; 28, 245-247.
Malaque CMS, Castro-Valencia JE, Cardoso JLC, França FOS, Barbaro K, Fan HW. Clinical and epidemiological features of definitive and presumed loxoscelism in São Paulo, Brazil. Revista do Instituto de Medicina Tropical de São Paulo. 2002; 44,139-143. Disponível em: http://dx.doi.org/10.1590/S0036-46652002000300005.
Miranda, ALS, Guerra-Duarte C., Lima, SA, Chávez-Olórtegui C, Soto-Blanco B. History, challenges and perspectives on Loxosceles (brown spiders) antivenom production in Brazil. Toxicon. 2021, 40-45. Disponível em: https://doi.org/10.1016/j.toxicon.2021.01.004
Silva PH, Silveira RB, Appel MH, Mangili OC, Gremisk W, Veiga SS. Brown spiders and loxoscelism. Toxicon. 2004.44, 693-709. https://doi.org/10.1016/j.toxicon.2004.07.012.
Smith CW, Micks DW. The role of polymorphonuclear leukocytes in the lesion caused by the venom of the brown spider. Laboratory Investigation 1970. 22, 90-93.
Tambourgi DV, Gonçalves-de-Andrade RM, van den Berg CW. Loxoscelism: From basic research to the proposal of new therapies. Toxicon. 2010. 15;56(7):1113-9. Disponível em: https://doi.org/10.1016/j.toxicon.2010.01.021.
Malaque CMS, Santoro ML, Cardoso JL, Conde MR, Novaes CTG, Risk JY, França FOS, Medeiros CR, Fan HW. Clinical picture and laboratorial evaluation in human loxoscelism. Toxicon. 2011. 58, 664-671. Disponível em: https://doi.org/ 10.1016/j.toxicon.2011.09.011.
Barbaro KC, Knysak I, Martins R, Hogan C, Winkel K. Enzymatic characterization, antigenic cross-reactivity and neutralization of dermonecrotic activity of five Loxosceles spider venoms of medical importance in the Americas. Toxicon. 2005. 45, 489-499. Disponível em: https://doi.org/10.1016/j.toxicon.2004.12.009.
Ministério da saúde, Brasil. Manual de diagnóstico e tratamento de acidentes por animais peçonhentos. Brasília: Assessoria de comunicação e educação em saúde – Fundação Nacional de Saúde. 2001. 45-56.
Peterson ME. Brown Spider Envenomation. Clinical techniques in Small Animal Practice. 2006. 21, 191-193. Disponível em: https://doi.org/10.1053/j.ctsap.2006.10.004.
Pauli I, Minozzo JC, Silva PH, Chaim OM, Veiga SS. Analysis of therapeutic benefits of antivenin at different time intervals after experimental envenomation in rabbits by venom of the brown spider (Loxosceles intermedia). Toxicon. 2009. 53, 660-671. Disponível em: https://doi.org/10.1016/j.toxicon.2009.01.033.
Costa TGF, Costal-Oliveira F, de Assis TCS, Lima SA, Martins CA, Finco AB, Veiga SS, Soccol VT, Machado-de-Ávila RA, Figueiredo LFM, Minozzo JC, Kalapothakis E, Guerra-Duarte C, Alvarenga LM, Chávez-Olórtegui C. Engineered antigen containing epitopes from Loxosceles spp. spider toxins induces a monoclonal antibody (Lox-mAb3) against astacin-like metalloproteases. International Journal of Biological Macromolecules. 2020. Nov 1;162:490-500. Disponível em: https://doi.org/10.1016/j.ijbiomac.2020.06.176.
Saavedra-Langer R, Costa TGF, Lima SA, Costal-Oliveira F, Martins CA, Machado-de-Ávila RA, Minozzo JC, Soccol VT, Guerra-Duarte C, Kalapothakis E, Chávez-Olórtegui C. A prokaryote system optimization for rMEPLox expression: A promising non-toxic antigen for Loxosceles antivenom production. International Journal of Biological Macromolecules. 2021 Sep 30;187:66-75. Disponível em: https://doi.org/10.1016/j.ijbiomac.2021.07.042.
Fortier LA. Stem cells: classifications, controversies, and clinical applications. Veterinary Surgery. 2005. 34, 415-423. Disponível em: https://doi.org/10.1111/j.1532-950X.2005.00063.x.
Minguell JJ, Erices A, Conget P. Mesenchymal stem cells. Experimental Biology and Medicine. 2001. 226, 507-520.
Jeong JH. Adipose Stem cells and skin repair. Current Stem Cell Research and Therapy. 2010. 5, 137-140.2010.
Gaur M, Dobke M, Lunyak VV. Mesenchymal stem cells from adipose tissue in clinical applications for dermatological indications and skin aging. International Journal of Molecular Sciences. 2017. 18, 208. Disponível em: https://doi.org/10.3390/ijms18010208.
Kim, W., Park, B., Sung, J., Yang, J., Park, S., Kwak, S., Park, J. Wound healing effect of adipose-derived stem cells: A critical role of secretory factors on human dermal fibroblasts. Journal of Dermatological Science. 2007. 48, 15-24. Disponível em: https://doi.org/10.1016/j.jdermsci.2007.05.018.
Kasperk C, Wergedal J, Strong D, Farley J, Wangerin K, Gropp H, Ziegler R, Baylink DJ. Human bone cell phenotypes differ depending on their skeletal site of origin. The Journal of Clinical Endocrinology and Metabolism. 1995. 80, 2511-2517. Disponível em: https://doi.org/10.1210/jcem.80.8.7629252.
Phillips S, Kohn M, Baker D, Vander Leest R, Gomez H, McKinney P, McGoldrick J, Brent J. Therapy of brown spider envenomation: a controlled trial of hyperbaric oxygen, dapsone, and cyproheptadine. Annals of Emergency Medicine.1995 Mar;25(3):363-8. Disponível em: https://doi.org/10.1016/s0196-0644(95)70296-2. PMID: 7864478.
Oliveira ST, Leme MC, Pippi NL, Raiser AG, Manfron MP. Preparations of comfrey (Symphytum officinale) on cutaneous wound healing in rats. Revista da FZVA. 2000. 7, 65-74
Wu Y, Chen L, Scott PG, Tredget EE. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem Cells. 2007. 25, 2648-2659.
Zhang J, Huang X, Wang H, Liu X, Zhang T, Wang Y, Hu D. The challenges and promises of allogeneic mesenchymal stem cells for use as a cell-based therapy. Stem Cell Research and Therapy. 2015. Disponível em: https://doi.org/10.1186/s13287-015-0240-9
Ferrara GIS, Fernandes-Pedrosa MF, Azevedo ILMJ, Andrade RMG, Portaro FCV, Almeida DM, Murakami M, Arni RK, Berg CW, Ho L, Tambourgi DV. Smase II, a new sphingomyelinase D from Loxosceles laeta venom gland: Molecular cloning, expression, function and structural analysis. Toxicon. 2009. 53, 743-753. Disponível em: https://doi.org/10.1016/j.toxicon.2009.02.013.
Elston DM, Miller SD, Young RJ, Eggers J, Mcglasson D, Schmidt WH, Bush A. Comparison of colchicine, dapsone, triamcinolone, and diphenhydramine therapy for the treatment of brown recluse spider envenomation. Archives of Dermatology. 2005. 141, 595-597. Disponível em: https://doi.org/10.1001/archderm.141.5.595.
Caplan AI. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. Journal of Cellular Physiology. 2007. 213, 341-347. Disponível em: https://doi.org/10.1002/jcp.21200.
Harman RJ. Stem cell therapy in veterinary dermatology. Veterinary Dermatology. 2013. 24, 90-e24. Disponível em: https://doi.org/10.1111/vde.12000.
Kim JW, Lee JH, Lyoo YS, Jung DI, Park HM. The effects of topical mesenchymal stem cell transplantation in canine experimental cutaneous wounds. Veterinary Dermatology. 2013. 24, 242-253. Disponível em: https://doi.org/10.1111/vde.12011.
Ospedal KZ, Appel MH, Neto JF, Mangili OC, Sanches V, Gremski W. Histopathological findings in rabbits after experimental acute exposure to the Loxosceles intermedia (brown spider) venom. International Journal of Experimental Pathology. 2002. 83, 287-294.
Maynor ML, Moon RE, Klitzman B, Fracica PJ, Canada A. Brown recluse spider envenomation: a prospective trial of hyperbaric oxygen therapy. Academic Emergency Medicine. 1997.4, 184-192.
Rees RS, Altenbern DP, Lynch JB, King Jr LE. Brown recluse spider bites. A comparison of early surgical excision versus dapsone and delayed surgical excision. Annals of Surgery. 1985. 202, 659-663.
Booth SA, Moody CE, Dahl MV, Herron MJ, Nelson RD. Dapsone suppresses integrin-mediated neutrophil adherence function. Journal of Investigative Dermatology. 1992. 98, 135-40.
Barret SM, Jenkings MR, Fisher DE. Dapsone or electric Shock therapy of brown recluse spider envenomation? Annals of Emergency Medicine. 1994. 24, 21-25.
Hogan CJ, Barbaro KC, Winkel K. Loxoscelism: old obstacles, new directions. Annals of Emergency Medicine. 2004. 44, 608-624. Disponível em: https://doi.org/10.1016/S0196064404013149.
Nauta AJ, Fibbe WE. Immunomodulatory properties of mesenchymal stromal cells. Blood. 2007. 110, 3499-3506. Disponível em: https://doi.org/10.1182/blood-2007-02-069716.
Jackson WM, Nesti LJ, Tuan, RS. Mesenchymal stem cell therapy for attenuation of scar formation during wound healing. Stem Cell Research and Therapy.2012. 3, 1-9. Disponível em: https://doi.org/10.1186/scrt111.
Reinke JM, Sorg H. Wound repair and regeneration. European Surgical Research 2012. 49, 35-43. Disponível em: https://doi.org/10.1159/000339613.
Hosgood G. Reparo de Feridas e Resposta Tecidual Específica à Lesão. In: SLATTER, D. Manual de cirurgia de pequenos animais. New York: Elsevier Science. 2003. Cap. 4, 66-86.
Downloads
Publicado
Como Citar
Edição
Seção
Licença
Copyright (c) 2022 Ciência Animal Brasileira / Brazilian Animal Science

Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.
Autores que publicam nesta revista concordam com os seguintes termos:
- Autores mantém os direitos autorais e concedem à revista o direito de primeira publicação, com o trabalho simultaneamente licenciado sob a Licença Creative Commons Attribution que permite o compartilhamento do trabalho com reconhecimento da autoria e publicação inicial nesta revista.
- Autores têm autorização para assumir contratos adicionais separadamente, para distribuição não-exclusiva da versão do trabalho publicada nesta revista (ex.: publicar em repositório institucional ou como capítulo de livro), com reconhecimento de autoria e publicação inicial nesta revista.
- Autores têm permissão e são estimulados a publicar e distribuir seu trabalho online (ex.: em repositórios institucionais ou na sua página pessoal) a qualquer ponto antes ou durante o processo editorial, já que isso pode gerar alterações produtivas, bem como aumentar o impacto e a citação do trabalho publicado (Veja O Efeito do Acesso Livre).






























