Resumo
O plasma rico em plaquetas autólogo (PRPa) e a fibrina rica em plaquetas autóloga (FRPa) são biomateriais derivados do sangue com potencial promissor para uso na otimização do processo de cicatrização de feridas. A rosuvastatina (RSV), uma estatina hipolipemiante, apresenta efeitos pleiotrópicos que podem melhorar a cicatrização, justificando o estudo de seu uso isoladamente ou em combinação com outros materiais para tais fins. Este estudo teve como objetivo avaliar a reepitelização de feridas com o uso do PRPa e FRPa autólogos associados ou não à rosuvastatina 1,2%. Foram utilizados dezesseis coelhos machos adultos da raça Nova Zelândia, clinicamente saudáveis, alocados aleatoriamente em dois grupos de 8 animais, cada grupo representando um biomaterial associado ou não à rosuvastatina 1,2%. As feridas cirúrgicas foram induzidas e tratadas com biomateriais e rosuvastatina 1,2% por 17 dias. Avaliação macroscópica da área total das feridas e a distância do epitélio em cortes histológicos foram realizadas. A correlação entre área de ferida e espessura de epitélio foi inversamente proporcional e com maior intensidade com o uso da FRPa (r = -0,5500). Não foi observada diferença na espessura de epitélio entre os grupos (p > 0,05). A área da ferida do PRPa isolado (p = 0,001), FRPa isolada (p = 0,021) e PRPa+RSV (p = 0,016) foram menores comparadas ao FRPa+RSV aos 14 dias. Esses achados sugerem que a rosuvastatina associada ao PRPa resultou em áreas menores de ferida comparada à PRFa, otimizando a cicatrização.
Abstract
Autologous platelet-rich plasma (aPRP) and autologous platelet-rich fibrin (aPRF) are blood-derived biomaterials that potentially enhance wound healing. Rosuvastatin (RSV), a lipidlowering statin, exhibits pleiotropic effects that may promote tissue repair, warranting investigation into its use alone or combined with biomaterials for wound healing. This study aims to evaluate the wound repair effects of aPRP and aPRF, with or without adding 1.2% rosuvastatin. Sixteen clinically healthy adult male New Zealand rabbits were randomly assigned to two groups of eight, each receiving one of the biomaterials either with or without 1.2% rosuvastatin. The biomaterials used were of autologous origin, specifically aPRP and aPRF. Surgical wounds were induced and treated with biomaterials and 1.2% rosuvastatin over 17 days. Macroscopic assessments of wound area and epithelial gap distance were conducted, supplemented by histological analysis. A significant inverse correlation was observed between wound area and epithelial thickness with the use of aPRF (r = -0.5500). No significant difference was found in epithelial thickness between treatment groups (p > 0.05). In terms of the wound area, aPRP alone (p = 0.001 ), aPRF alone (p = 0.021 ), and aPRP+RSV (p = 0.016) treatments yielded smaller wound areas compared to aPRF+RSV at 14 days post-treatment. These findings suggest that the addition of 1.2% rosuvastatin to aPRP resulting in a smaller wound area compared to aPRF, enhances wound repair.
Keywords:
biocompatible materials; statins; lipid-lowering drug; wound repair
1. Introdução
A reparação tecidual é um processo complexo e multifásico. A reepitelização, essencial para o fechamento da ferida, dependente da sincronização e do balanço dos mecanismos de proliferação, diferenciação e maturação de células progenitoras em células epiteliais (1). Prolongada inflamação pode interromper tais processos, potencialmente levando à cronificação e impedindo a cicatrização (2).
Biomateriais hemoderivados são amplamente estudados pelos seu potencial de otimizar o processo de cicatrização (3,4,5,6). O plasma rico em plaquetas (PRP) e a fibrina rica em plaquetas (FRP) são conhecidos pela alta concentração plaquetária e de fatores de crescimento (7, 8), melhorando a cicatrização através do incremento na síntese de colágeno (9), estimulando a ativação de fibroblastos e angiogênese (10). A combinação de biomateriais a outros fármacos pode promover uma cicatrização mais eficaz.
A Rosuvastatina (RSV), uma estatina hipolipemiante, tem demonstrado propriedades anti-inflamatórias benéficas na cicatrização de feridas e na odontologia (11). Também promove proliferação endotelial (12), angiogênese, linfoangiogênese (13) e recrutamento de fibroblastos (10), tudo que pode contribuir para a reparação tecidual. A administração tópica oferece diversas vantagens frente à via oral, incluindo redução na degradação hepática, menores efeitos colaterais sistêmicos, fácil aplicação, boa distribuição em grandes áreas, acelera cicatrização e reduz resistência bacteriana (14,15).
O presente estudo objetivou mensurar a eficácia cicatricial do plasma rico em plaquetas autólogo (PRPa) e da fibrina rica em plaquetas autóloga (FPRa), associados ou não à rosuvastatina 1,2%, avaliando a contração da ferida e espessura de epitélio. Nós também exploramos a correlação destes parâmetros, tendo por hipótese que os biomateriais combinados com a rosuvastatina promoveriam o fechamento de ferida mais rápido.
2. Material e métodos
Este estudo foi aprovado pelo Comitê de Ética e Uso de Animais (CEUA) da Universidade do Oeste Paulista (UNOESTE) sob o protocolo 3840, aderindo as diretrizes do Conselho Nacional de Controle de Experimentação Animal(15), do guia para cuidados e uso de animais de laboratório (17) e das diretrizes ARRIVE (18).
Dezesseis coelhos machos da raça Nova Zelândia clinicamente saudáveis (pesando 3 ± 1 kg) alocados individualmente e alimentados com ração e água ad libitum foram utilizados. Os coelhos foram aleatoriamente separados em dois grupos com oito cada, cada grupo representaria um biomaterial, utilizado isolado ou combinado com rosuvastatina 1,2%, e a ferida controle. Os biomateriais foram PRP e FRP autólogos. Quatro feridas equidistantes foram induzidas na região dorsal de cada coelho, uma foi tratada com cloreto de sódio 0,9% como controle, outra com biomaterial isolado (PRPa ou FRPa), outra com rosuvastatina 1,2% isolada, e outra com associação de um biomaterial com rosuvastatina 1,2% (PRPa+RSV ou FRPa+RSV).
A rosuvastatina 1,2% foi preparada em duas apresentações, liquida e gel, com 20% de glicerina e um polímero de metilcelulose (Aristofelx® Gel, São Paulo, Brasil) como veículo, homegenizados em banho maria a 50-60°C, segundo Grover et al.(19). Os biomateriais autólogos foram preparados com 4 ml de sangue coletados da veia auricular utilizando scalp 23G. Para o plasma rico em plaquetas autólogo (PRPa) o sangue foi condicionado em tubos com anticoagulante citrato de sódio e submetidos a protocolo de dupla centrifugação (20,9): inicialmente a 200G por 10 minutos (Excelsa Baby 206R, Fanem), com a separação do plasma pobre em plaquetas (PPP) dos demais constituintes sanguíneos. O PPP foi misturado a 200 μL da fração vermelha e centrifugado novamente a 400G por 10 minutos, obtendo-se o PRPa. Em outro tubo, 400 μL de PRPa foi acrescido de 100 μL de gluconato de cálcio 10% para ativação. Para os tratamentos com PRPa associado a rosuvastatina 1,2%, 200 μL de cada componente foi utilizado acrescido de 100 μL de gluconato de cálcio 10%, obtendo-se sempre o volume final de 0,5 mL para ambos os casos (21,22).
Para a fibrina rica em plaquetas (FRPa), o sangue foi condicionado em tudo sem anticoagulante, após coagulação natural, centrifugado a 200G por 10 minutos como descrito por Azevedo (2014)(23). A porção superior contendo a FRPa foi separada e utilizada isolada ou associada com rosuvastatina 1,2% gel(10).
O protocolo anestésico foi cloridrato de xilazina 2% (Xilazin®) e tiletamina com zolapezam (Zoletil® 50) intramuscular nas doses de 5 mg/kg e 15 mg/kg, respectivamente, seguido do bloqueio local com 0,1 ml_ de cloridrato de lidocaína 2% com vasoconstritor por local para indução das feridas e biopsias (9). Para a analgesia pós procedimento foi utilizado cloridrato de tramadol 0,5 mg/kg intramuscular duas vezes ao dia, por 3 dias(24). As feridas foram induzidas utilizando punch de 8mm, e as biópsias com punch de 2 mm em locais específicos na ferida durante os momentos. As biopsias eram realizadas a 1 hora no dia 7, às 5 horas no dia 14 e às 8 horas no dia 17.
Com contenção manual, realizou-se tricotomía da região dorsal criando área larga suficiente para indução de quatro feridas. A ferida superior esquerda serviu de controle, tratada com cloreto de sódio 0,9%; a inferior esquerda tratada com rosuvastatina 1,2% gel; a superior direita recebeu um dos biomateriais autólogos isolado (PRPa ou FRPa), e a inferior direita um biomaterial autólogo combinado com rosuvastatina 1,2%. Curativo adesivo (Band-Aid®) e bandagem de rayon estéril foram utilizados após os tratamentos; o curativo geralmente se desprendia no dia seguinte, e as feridas permaneciam abertas até o próximo tratamento. Os coelhos e as feridas eram inspecionados diariamente durante o estudo.
Os tratamentos e trocas de curativo eram conduzidas a cada 4 dias por 16 dias, exceto a primeira troca, a qual foi realizada após 3 dias da indução da ferida (25,22). As mensurações das feridas e biopsias foram realizadas com paquímetro digital nos dias 0, 7, 14 e 17 para calcular a área da feria (26). As amostras das biopsias foram fixadas em formalina 10% por 24 horas, embebidas em parafina, seccionadas fragmentos de 4 μm, e coradas com Hematoxilina e Eosina (HE). Realizada a última biopsia os animais foram eutanasiados utilizando câmara de gás carbônico (24). As imagens para mensuração da espessura de epitélio foram obtidas utilizando software Motic® a 40x de magnificação, e com o software Image J® calibrado mensurou-se a espessura em μm. Três medidas da espessura do epitélio - mínimo, máximo e mediano - foram realizadas por um único analisador e de forma cega (27,28).
Para análise estatística o software Jamovi® foi utilizado e os gráficos gerados com GraphPad Prism®. Os dados da área da ferida e espessura do epitélio foram testados para normalidade com o teste de Shapiro-Wilk, revelando uma distribuição anormal. Subsequente, o teste Kruskal-Wallis seguido de post hoc Dwass-Steel-Critchlow-Fligner (DSCF) foi aplicado comparando grupos, enquanto o teste de Friedman e post hoc Durbin-Conover para avaliação dos momentos, com nível de significância de 5%. A correlação de Sperman foi realizada entre as variáveis, categorizando a correlação em fraca (0,2 ≤ |r| < 0,4), moderada (0,4 ≤ | r | < 0,7) e forte (0,7 ≤ | r | < 0,9). Para comparar os biomateriais, dados dos biomateriais autólogos isolados e associados com rosuvastatina 1,2% foram reavaliados. A normalidade foi testada com teste de Shapiro-Wilk, confirmando distribuição anormal. Testes de Kruskal-Wallis e DSCF foram utilizados para comparação entre grupos, enquanto teste de Friedman e Durbin-Conover entre momentos, mantendo-se nível de significância de 5%.
3. Resultados
Não foi observada diferença significativa entre grupos nas médias de área de ferida coma utilizaçãodo PRPa, associado ou não com RSV 1,2%, em nenhum momento avaliado. Todos os grupos mostraram menores áreas no dia 14 comparado ao dia 17 (p < 0,05). Já as feridas tratadas com FRPa, associadas ou não com RSV 1,2%, as feridas também foram menores no dia 14 e 17 comparada ao dia 7 (p < 0,05). Nenhuma diferença foi encontrada entre grupos no dia 7 e 17. No dia 14, feridas tratadas com FRPa (p = 0,016) e do NaCI (p = 0,008) exibiram áreas menores que o grupo FRPa+RSV, que tinham áreas de ferida maiores.
Dados de área de feridas (mm2) de feridas cirúrgicas induzidas tratadas com plasma rico em plaquetas autólogo (PRPa) (A) e fibrina rica em plaquetas autóloga (FRPa) (B) isolados ou associados com rosuvastatina 1,2% por 17 dias. NaCI: cloreto de sódio 0,9% (controle); FRPa: fibrina rica em plaquetas autóloga; PRPa: plasma rico em plaquetas autólogo; RSV: rosuvastatina 1,2%; M7, M14 e M17 são os dias após indução da ferida. Teste Kruskal Wallis seguido de Dwass-Steel-Critchlow-Fligner para grupos e Friedman e Durbin-Conover para momentos, 5% de significância. *: diferença do M7; #: diferença do M14; & diferença do aPRF+RSV.
Comparando as áreas entre grupo tratados com biomateriais autólogos ¡solados e combinados com RSV 1,2%, no dia 14 e 17 obtiveram áreas menores que no dia 7 (p < 0.05). No dia 14 os grupos PRPa isolado (p = 0,001 ), FRPa isolado (p = 0,021 ), e PRPa+RSV (p = 0,016) exibiram menores áreas de ferida comparada ao grupo FRPa+RSV.
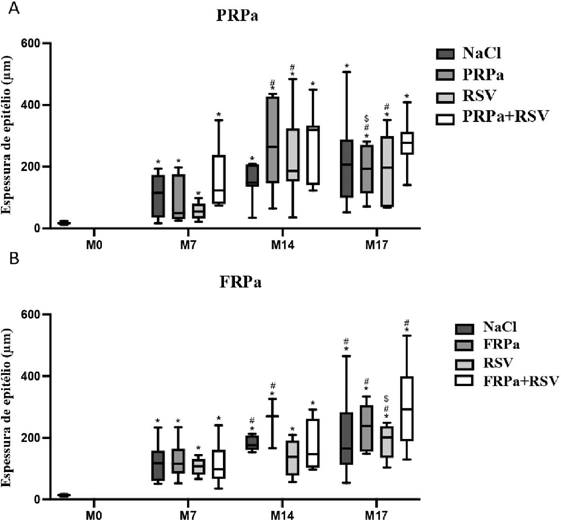
A espessura de epitélio (Figura 2) de feridas tratadas com PRPa, associado ou não com RSV 1,2%, consistentemente obtiveram maior espessura que a pele normal (p < 0,05), não submetida a lesão ou tratamento. Somente os grupos PRPa e RSV 1,2% demonstraram aumento de espessura no dia 14 (p < 0,001) e no dia 17 (p = 0,014) comparado ao dia 7. O grupo PRPa foi o único a exibir uma regressão na espessura de epitélio no dia 17 comparado ao dia 14 (p = 0,003).
Dados de espessura de epitélio (μm) de feridas cirúrgicas induzidas tratadas com plasma rico em plaquetas autólogo (PRPa) (A) e fibrina rica em plaquetas autóloga (FRPa) (B) isolados ou associados com rosuvastatina 1,2% por 17 dias. NaCI: cloreto de sódio 0,9% (controle); FRPa: fibrina rica em plaquetas autóloga; PRPa: plasma rico em plaquetas autólogo; RSV: rosuvastatina 1,2%; M7, M14 e M17 são os dias após indução da ferida. Teste Kruskal Wallis seguido de Dwass-Steel-Critchlow-Fligner para grupos e Friedman e Durbin-Conover para momentos, 5% de significância. *: diferença do MO; #: diferença do M7; $ diferença do M14.
Feridas tratadas com FRPa, associadas ou não com RSV 1,2%, também mostraram maiores espessura de epitélio comparada à pele normal em todos os momentos de avaliação (p < 0,05). No grupo NaCI, dia 14 (p = 0,014) e dia 17 (p = 0,014) diferiram do dia 7, assim como o grupo FRPa no dia 14 (p = 0,005) e 17 (p = 0,013) comparado ao 7. No grupo RSV 1,2%, no dia 17 obteve maior espessura que no dia 7 (p = 0,004) e 14 (p = 0,028). No grupo FRPa+RSV, somente o dia 17 diferiu do dia 7 (p = 0,034), com maior espessura ao longo dos momentos. Quando comparado os biomateriais autólogos isolados ou combinados associados com RSV 1,2% não se obteve diferença de espessura de epitélio entre grupos nos momentos avaliados. O grupo PRPa, nos dias 14 (p < 0,001) e 17 (p < 0,001) diferiram do dia 7, e o dia 17 também diferiu do dia 14 (p = 0,018). O grupo FRPa mostrou diferença nos dias 14 (p = 0,024) e 17 (p = 0,047) comparado ao dia 7.
Dados de área de ferida (mm2) (A) e espessura de epitélio (μm) (B) de feridas cirurgicamente induzidas em coelhos tratadas com biomateriais autólogos isolados ou associados com rosuvastatina 1,2% por 17 dias. NaCI: cloreto de sódio 0,9% (controle); FRPa: fibrina rica em plaquetas autóloga; PRPa: plasma rico em plaquetas autólogo; RSV: rosuvastatina 1,2%; M7, M14 e M17 são os dias após indução da ferida. Teste Kruskal Wallis seguido de Dwass-Steel-Critchlow-Fligner para grupos e Friedman e Durbin-Conover para momentos, 5% de significância. *: diferença do M7; #: diferença do M14; &: diferença do FRPa+RSV.
Foi obtida correlação negativa entre área de ferida e espessura de epitélio, indicando que menores áreas de feridas tendem a ser associadas com maiores espessuras de epitélio. No presente trabalho, a correlação foi mais intensa com FRPa (r = -0.5500) do que com PRPa (r = -0.4436), com esses biomateriais associados ou não com RSV 1,2%
Dados da correlação de Spearman da área de ferida (mm2) e espessura de epitélio (μm) de feridas cirúrgicas induzidas tratadas com plasma rico em plaquetas autólogo (PRPa) (A) e fibrina rica em plaquetas autóloga (FRPa) (B) isolados ou associados com rosuvastatina 1,2% por 17 dias. NaCI: cloreto de sódio 0,9% (controle); FRPa: fibrina rica em plaquetas autóloga; PRPa: plasma rico em plaquetas autólogo; RSV: rosuvastatina 1,2%; M7, M14 e M17 são os dias após indução da ferida. A matriz de correlação < 0,2 \r\ < 0,4 para correlação fraca, 0,4 ≤ |r| < 0,7 moderada e 0,7 ≤ |r| < 0,9 forte, considerando 5% de nível de significância.
Representação esquemática da aparência macroscópica de feridas cirurgicamente induzidas em coelhos tratadas com biomateriais autólogos isolados ou associados com rosuvastatina 1,2% por 17 dias. NaCI: cloreto de sódio 0,9% (controle); FRPa: fibrina rica em plaquetas autóloga; PRPa: plasma rico em plaquetas autólogo; RSV: rosuvastatina 1,2%; M7, M14 e M17 são os dias após indução da ferida. Somente o grupo FRPa que obteve fechamento completo da ferida.
Representação esquemática de cortes histológicos de feridas cirurgicamente induzidas em coelhos e tratadas com biomateriais autólogos isoladados ou associados com rosuvastatina 1,2% por 17 dias. Coloração HE, 40x; NaCI: cloreto de sódio 0,9% (controle); FRPa: fibrina rica em plaquetas autóloga; PRPa: plasma rico em plaquetas autólogo; RSV: rosuvastatina 1,2%; M7, M14 e M17 são os dias após indução da ferida. Observar o incremento da espessura de epitélio em todos os grupos, e a regressão no grupo PRPa no M17.
4. Discussão
Este estudo avaliou a cicatrização de ferida pela mensuração da área e espessura de epitélio, investigando os efeitos do PRFa e PRPa, associados ou não com RSV 1,2%. Os resultados demonstraram que ambos os grupos FRPa isolado e NaCI exibiram feridas menores comparado ao grupo FRPa+RSV no dia 14. De forma similar, os grupos PRPa isolado e PRPa+RSV também demonstraram áreas de feridas menores que FRPa+RSV. Não foram observadas diferença na espessura de epitélio entre grupos. Estudos anteriores por Xu et al.(28) destacaram que tanto comprimento como espessura do epitélio neoformado serviam como variáveis mensuráveis na quantificação da reepitelização. De forma similar, Sun et al.(27) utilizaram a espessura de epitélio para mensurar este parâmetro em feridas de queimadura. Nossos achados indicam que o uso do PRPa promove reepitelização mais precoce, como evidenciado pela regressão da espessura epitelial do M14 para o M17 (p=0.018), consistente com a progressão entre as fases de cicatrização, da granulação para remodelação (2). Este efeito pode ser atribuído à liberação de fatores de crescimento mais precoce do PRP em comparação à FRP(29).
Khalifa et al.(30) comparam os efeitos do PRPa e FRPa em feridas induzidas em cães, obtendo que ambos os tratamentos facilitaram a completa reepitelização. Entretanto, o uso do PRPa resultou em maiores espessuras de epitélio comparado ao FRPa. Apesar disto, os autores não encontraram diferença estatística no efeito cicatricial entre estes biomateriais. Isto apoia nossos resultados, que também não mostraram diferença significativa na espessura de epitélio entre PRPa e FRPa.
Snowden(31) concluiu em 1984 que a contração da ferida e a reepitelização são constantes lineares, e quando avaliadas juntas por um período adequado, servem como parâmetros adequados para comparação quantitativa do comportamento de feridas incisionals. Mais recente, em 2022, Buli et al.(32) estudaram úlceras venosas em pernas, focando na redução da área total, porcentagem de redução de área e avanço da margem da ferida. Determinaram que essas métricas de cicatrização exibiam uma trajetória linear e similar durante um período de quatro semanas.
Este trabalho monitorando a área total da ferida por 17 dias, obteve significativamente feridas menores aos 14 dias pós indução, independente do tratamento utilizado. Embora alguns estudos alcançarem total cicatrização com este período, o uso do punh de 8mm e biópsias subsequentes podem ter contribuído na manutenção da abertura da ferida. Apesar disto, neste estudo, o grupo FRPa isolado apresentou completa cicatrização de feridas com 17 dias. Balse and Baliga(33) reportaram que FRP melhora a cicatrização de tecidos mole e regeneração óssea mais efetivamente que PRP quando utilizados como enxertos seguido de extração dentária. Em contraste, Yerke et al.(34) não observaram diferença macroscópica na cicatrização de tecidos moles entre PRPa e FRPa em sítios de extração dentária. Nossos achados demonstraram uma moderada correlação (0,4 ≤ |r| < 0,7) entre área de ferida e espessura de epitélio utilizando estes biomateriais. Aos 14 dias, nós observamos áreas menores de feridas comparado ao dia 7 (p<0,05), mas sem diferenças significativas entre PRPa e FRPa.
Khalafe Salih(35) trataram feridas crônicas induzidas em cabras com PRP e FRP, observaram que promoveram reparo tecidual e reepitelização mais rapidamente que o grupo controle. Entretanto, eles não distinguiram qual biomaterial teve um melhor desempenho, um achado consistente com outros estudos (35,37,38) onde também não foi possível determinar uma preferência entre os biomateriais para as variáveis avaliadas, apoiando nossos resultados.
Neste estudo, o desempenho dos biomateriais associados a ou não à rosuvastatina 1,2% foram reavaliadas. Aos 14 dias nós observamos, que os grupos PRPa isolado, FRPa isolado e PRPa+RSV obtiveram menores áreas de ferida comparadas à FRPa+RSV, indicando que a associação RSV 1,2% com PRPa foi mais efetiva que com FRPa. Entretanto, estes achados contrastam com os resultados de Ferreira et al.(10), que obtiveram melhora significativa na quantidade de fibroblastos e neovascularização da associação com FRPa ao invés do PRPa. Adicionalmente, a associação da RSV 1,2% e PRPa na cicatrização de feridas foi posteriormente avaliada em estudo histopatológico (22) e em relação à qualidade de colágeno (21), ambos os quais produziram resultados promissores.
Pradeep et al.(39) encontraram que a associação de RSV 1,2% gel com FRPa em enxertos ósseos para defeitos mandibulares foi sinérgico e significativamente melhorou os parâmetros avaliados. Entretanto, nosso estudo não observou tal sinergismo. Aos 14 dias, ambos grupos RSV 1,2% isolada e FRPa+RSV exibiram áreas de feridas maiores comparada ao FRPa isolada (p=0.016). Nos dias 7 e 17, não houve diferença significativa entre grupos, o que foi consistente com os resultados obtidos quando utilizado PRPa. Na odontologia, Gautam et al.(40) que também utilizaram RSV 1,2% gel combinada com FRP, reportaram resultados favoráveis no tratamento de defeitos intraósseos em pacientes com periodontite crônica. Em nosso estudo, a mesma concentração de RSV foi utilizada em ambas as formas, liquida para misturar com PRP e em gel, para tratamento individual e associação com FRP. A variação de desempenho das associações com RSV podem ter sido influenciados pelos diferentes veículos utilizados em cada formulação. As diversas conclusões obtidas de estudos que examinaram a associação de biomateriais com RSV no processo de cicatrização destacam a necessidade de mais pesquisas. Avaliações mais sofisticadas dos seus mecanismos de ação são essenciais para compreender plenamente as interações e seus potenciais benefícios.
5. Conclusão
A associação da rosuvastatina com plasma rico em plaquetas autólogo ou biomateriais autólogos isolados resultou em áreas de feridas menores comparadas à associação com fibrina rica em plaquetas autóloga, sugerindo um impacto positivo na cicatrização de feridas. Não foram observadas diferenças na espessura de epitélio entre os tratamentos. No entanto, foi observada correlação moderada entre área da ferida e a espessura do epitélio nos tratamentos que utilizaram ambos os biomateriais autólogos, associados ou não à rosuvastatina. Outros estudos são essenciais para melhor entendimento dos mecanismos de ação destes biomateriais e da rosuvastatina, bem como da influência desses fatores na cicatrização de feridas.
Declaração de disponibilidade de dados
Os dados serão fornecidos mediante solicitação ao autor correspondente.
Agradecimentos
Nós gostaríamos de agradecer ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela bolsa PIBIC O estudo foi financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP - número de processo 2016/25938-0).
Referências bibliográficas
-
1 Gurtner GC, Werner S, Barrandon Y, Longaker MT. Wound repair and regeneration. Nature. 2008;453(7193):314-321. https://doi.org/10.1038/nature07039
» https://doi.org/10.1038/nature07039 -
2 Pastar I, Stojadinovic O, Yin NC, Ramirez H, Nusbaum AG, Sawaya A, et al. Epithelialization in wound healing: a comprehensive review. Adv Wound Care. 2014;3(7):445-464. https://doi.org/10.1089/wound.2013.0473
» https://doi.org/10.1089/wound.2013.0473 -
3 Roy S, Driggs J, Elgharably H, Biswas S, Findley M, Khanna S, et al. Platelet-rich fibrin matrix improves wound angiogenesis via inducing endothelial cell proliferation. Wound Repair Regen. 2011;19(6):753-766. https://doi.org/10.1111/j.1524-475X.2011.00740.x
» https://doi.org/10.1111 /j.1524-475X.2011.00740.x. -
4 Hermeto LC, Rossi RD, Pádua SBD, Pontes ERJ, Santana AE. Comparative study between fibrin glue and platelet rich plasma in dogs skin grafts. Acta Cir Bras. 2012;27:789-794. https://doi.org/10.1590/S0102-86502012001100008
» https://doi.org/10.1590/S0102-86502012001100008 -
5 Desai CB, Mahindra UR, Kini YK, Bakshi MK. Use of platelet-rich fibrin over skin wounds: Modified secondary intention healing. J Cutan Aesthet Surg. 2013;6(1 ):35. https://doi.org/10.4103/0974-2077.110096
» https://doi.org/10.4103/0974-2077.110096 -
6 Ehrenfest DMD, Andia I, Zumstein MA, Zhang CQ, Pinto NR, Bielecki T. Classification of platelet concentrates (Platelet-Rich Plasma-PRP, Platelet-Rich Fibrin-PRF) for topical and infiltrative use in orthopedic and sports medicine: current consensus, clinical implications and perspectives. Muscles Ligaments Tendons J. 2014;4(1):3. (https://pmc.ncbi.nlm.nih.gov/articles/PMC4049647/)
» https://pmc.ncbi.nlm.nih.gov/articles/PMC4049647/) -
7 Prakash S, Thakur A. Platelet concentrates: past, present and future. J Maxillofac Oral Surg. 2011;10(1):45-49. https://doi.org/10.1007/s12663-011-0182-4
» https://doi.org/10.1007/s12663-011-0182-4 -
8 Sanchez-González DJ, Méndez-Bolaina E, Trejo-Bahena NI. Platelet-rich plasma peptides: key for regeneration. Int J Pept. 2012;2012:532519. https://doi.org/10.1155/2012/532519
» https://doi.org/10.1155/2012/532519 -
9 Barrionuevo DV, Laposy CB, Abegão KGB, Nogueira RMB, Nai GA, Bracale BN, et al. Comparison of experimentally-induced wounds in rabbits treated with different sources of platelet-rich plasma. Lab Anim. 2015;49(3):209-214. https://doi.org/10.1177/0023677214567747
» https://doi.org/10.1177/0023677214567747 -
10 Ferreira NGO, Vicentini YF, Breda MRS, Nogueira RMB, Nai GA, Santarém CL. Uso de biomateriais e rosuvastatina tópica aumenta angiogênese de feridas cirúrgicas em coelhos. Res Soc Dev. 2021;10(1). https://doi.org/10.33448/rsd-v10i1.11327
» https://doi.org/10.33448/rsd-v10i1.11327 -
11 Bao JW, Sun B, Ma PP, Gai YS, Sun WZ, Yu HQ, et al. Rosuvastatin inhibits inflammatory response and resists fibrosis after myocardial infarction. Eur Rev Med Pharmacol Sci. 2018;22(1). https://doi.org/10.26355/eurrev_201801_14123
» https://doi.org/10.26355/eurrev_201801_14123 -
12 Pradeep AR, Karvekar S, Nagpal K, Patnaik K, Guruprasad CN, Kumaraswamy KM. Efficacy of locally delivered 1.2% rosuvastatin gel to non-surgical treatment of patients with chronic periodontitis: A randomized, placebo-controlled clinical trial. J Periodontol. 2015;86(6):738-745. https://doi.org/10.1902/jop.2015.140631
» https://doi.org/10.1902/jop.2015.140631 -
13 Asai J, Takenaka H, Hirakawa S, Sakabe JI, Hagura A, Kishimoto S, et al. Topical simvastatin accelerates wound healing in diabetes by enhancing angiogenesis and lymphangiogenesis. Am J Pathol. 2012;181 (6):2217-2224. https://doi.org/10.1016/j.ajpath.2012.08.023
» https://doi.org/10.1016/j.ajpath.2012.08.023 -
14 Salem, H.F.; Nafady, M.M.; Ewees, M.G.E.-D.; Hassan, H.; Khallaf, R.A. Rosuvastatin calcium-based novel nanocubic vesicles capped with silver nanoparticles-loaded hydrogel for wound healing management: Optimization employing Box-Behnken design: In vitro and in vivo assessment. J. Liposome Res. 2022, 32, 45-61. https://doi.org/10.1080/08982104.2020.1867166
» https://doi.org/10.1080/08982104.2020.1867166 -
15 Aly, U.F.; Abou-Taleb, H.A.; Abdellatif, A.A.; Tolba, N.S. Formulation and evaluation of simvastatin polymeric nanoparticles loaded in hydrogel for optimum wound healing purpose. Drug Des. Dev. Ther. 2019,13,1567-1580. https://doi.org/10.2147/DDDT.S198413
» https://doi.org/10.2147/DDDT.S198413 -
16 Diretrizes da prática de eutanásia do CONCEA (2013). In: Ministério Da Ciência, Tecnologia e Inovação, Conselho Nacional de Controle de Experimentação Animal - CONCEA. https://antigo.mctic.gov.br/mctic/opencms/legislacao/outros_atos/resolucoes/Resolucao_CONCEA_n_37_de_15022018.html
» https://antigo.mctic.gov.br/mctic/opencms/legislacao/outros_atos/resolucoes/Resolucao_CONCEA_n_37_de_15022018.html -
17 National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals: Environment, housing and management. 8th ed. The National Academic Press. https://doi.org/10.17226/12910
» https://doi.org/10.17226/12910 -
18 Percie du Sert N, Hurst V, Ahluwalia A, Alam S, Avey MT, Baker M, et al. The ARRIVE guidelines 2.0: Updated guidelines for reporting animal research. PLoS Biol. 2020;18(7):e3000410. https://doi.org/10.1371/journal.pbio.3000410
» https://doi.org/10.1371/journal.pbio.3000410 -
19 Grover HS, Kapoor S, Singh A. Effect of topical simvastatin (1,2 mg) on gingival crevicular fluid interleukin-6, interleukin-8 and interleukin-10 levels in chronic periodontitis- a clinic biochemical study. J Oral Biol Craniofac Res. 2016;6(2):85-92. https://doi.org/10.1016/j.jobcr.2015.11.003
» https://doi.org/10.1016/j.jobcr.2015.11.003 -
20 Abegão KGB, Bracale BN, Delfim IG, Santos ESD, Laposy CB, Nai GA, et al. Effects of heterologous platelet-rich plasma gel on standardized dermal wound healing in rabbits. Acta Cir Bras. 2015;30:209-215. https://doi.org/10.1590/S0102-865020150030000008
» https://doi.org/10.1590/S0102-865020150030000008 -
21 Taniguchi BA, Breda MRS, Nogueira RMB, Nai GA, Laposy CB. Fractal features of rabbit dermal wounds treated with platelet-rich plasma and topical rosuvastatin. Int J Clin Exp Pathol. 2018;11 (11):5241. (https://pmc.ncbi.nlm.nih.gov/articles/PMC6963036/)
» https://pmc.ncbi.nlm.nih.gov/articles/PMC6963036/) -
22 Tetila AF, Breda MRS, Nogueira RMB, Nai GA, Laposy CB. The use of platelet-rich plasma and rosuvastatin in wound healing in rabbits: a longitudinal study. Adv Skin Wound Care. 2019;32(9):1 -5. https://doi.org/10.1097/01.ASW.0000577136.88748.68
» https://doi.org/10.1097/01.ASW.0000577136.88748.68 -
23 Azevedo, M.C.M.P.S. Aplicação do PRF em medicina dentária. 2014. 29f. 51. Dissertação (Mestrado Integrado em Medicina Dentária) - Faculdade de Medicina Dentária, Universidade do Porto - Portugal. 2014. (https://hdl.handle.net/10216/75440)
» https://hdl.handle.net/10216/75440) - 24 Kanashiro GP, Cassu RN. Anestesia em animais selvagens e de laboratório. In: Andrade SF. Manual de terapêutica veterinária. 3rd ed. Roca; 2008. pp.728-745.
-
25 Vendramin FS, Franco D, Schamall RF, Franco TR. Utilização do plasma rico em plaquetas autólogo em enxertos cutâneos em coelho. Rev Bras Cir Plástica. 2010;25:4-10. (https://www.rbcp.org.br/details/549/pt-BR)
» https://www.rbcp.org.br/details/549/pt-BR) -
26 Carvalho V, Gomes FSL, Carmo DJ, Batista JA, Viana MN. Planimetría como método para mensuração de feridas. Rev Mineira Enferm. 2006;10(4):425-428. https://doi.org/10.35699/reme.v10i4.50743
» https://doi.org/10.35699/reme.v10i4.50743 -
27 Sun Y, Cao Y, Zhao R, Xu F, Wu D, Wang Y. The role of autologous APRP on deep partial-thickness burn wound healing in bama pigs. J Burn Care Res. 2020;41(3):657-662. https://doi.org/10.1093/jbcr/iraa012
» https://doi.org/10.1093/jbcr/iraa012 -
28 Xu P, Wu Y, Zhou L, Yang Z, Zhang X, Hu X, et al. Platelet-rich plasma accelerates skin wound healing by promoting re-epithelialization. Burns Trauma. 2020;8: tkaa028. https://doi.org/10.1093/burnst/tkaa028
» https://doi.org/10.1093/burnst/tkaa028. -
29 Kobayashi E, et al. Comparative release of growth factors from PRP, PRF, and advanced-PRF. Clin Oral Investig. 2016;20:2353-60. https://doi.org/10.1007/s00784-016-1719-1
» https://doi.org/10.1007/s00784-016-1719-1 -
30 Khalifa OA, Elkasapy A, Sallam EA, Marei YM, Mohammed LS. Effect of Autologous platelet-rich plasma versus platelet-rich fibrin on the Second Intension Wound Healing in Dogs through higher regeneration capacity and modulation of inflammatory cytokines. Benha Vet Med J. 2021 ;41 (1):1-7. https://doi.org/10.21608/BVMJ.2021.92616.1465
» https://doi.org/10.21608/BVMJ.2021.92616.1465 -
31 Snowden JM. Wound closure: an analysis of the relative contributions of contraction and epithelialization. J Surg Res. 1984;37(6):453-463. https://doi.org/10.1016/0022-4804(84)90213-0
» https://doi.org/10.1016/0022-4804(84)90213-0 -
32 Bull RH, Staines KL, Collarte AJ, Bain DS, Ivins NM, Harding KG. Measuring progress to healing: A challenge and an opportunity. Int Wound J. 2022;19(4):734-740. https://doi.org/0.1111/iwj.13669
» https://doi.org/0.1111/iwj.13669 -
33 Balse NS, Baliga S. "Evaluation of wound healing and bone regeneration using autologous platelet-rich plasma and platelet-rich fibrin postextractions": A comparative study. Indian J Health Sci Biomed Res KLEU. 2017;10(2):167-172. https://doi.org/10.4103/kleuhsj.ijhs_395_16
» https://doi.org/10.4103/kleuhsj.ijhs_395_16 -
34 Yerke LM, Jamjoom A, Zahid TM, Cohen RE. The effect of platelet-rich fibrin, calcium sulfate hemihydrate, platelet-rich plasma and resorbable collagen on soft tissue closure of extraction sites. J Funct Biomater. 2017;8(2):17. https://doi.org/10.3390/jfb8020017
» https://doi.org/10.3390/jfb8020017 -
35 Khalaf FH, Salih SI. Clinical and histopathological evaluation of using platelet-rich plasma and platelet-rich fibrin matrix in treatment of induced chronic open wounds in bucks. Asian J Pharm Clin Res. 2018;11 (5):337-341. https://doi.org/10.22159/ajpcr.2018.v11i5.24105
» https://doi.org/10.22159/ajpcr.2018.v11i5.24105 -
36 Kim TH, Kim SH, Sándor GK, Kim YD. Comparison of platelet-rich plasma (APRP), platelet-rich fibrin (APRF), and concentrated growth factor (CGF) in rabbit-skull defect healing. Arch Oral Biol. 2014;59(5):550-558. https://doi.org/10.1016/j.archoralbio.2014.02.004
» https://doi.org/10.1016/j.archoralbio.2014.02.004 -
37 Bansal S, Garg A, Khurana R, Chhabra P. Platelet-rich fibrin or platelet-rich plasma-which one is better? an opinion. Indian J Dent Sci. 2017;9(Suppl 1):S49-S52. https://doi.org/10.4103/IJDS.IJDS_55_17
» https://doi.org/10.4103/IJDS.IJDS_55_17 -
38 Xiong S, Qiu L, Su Y, Zheng H, Yi C. Platelet-rich plasma and platelet-rich fibrin enhance the outcomes of fat grafting: a comparative study. Plast Reconstr Surg. 2019;143(6):1201e-1212e. https://doi.org/10.1097/PRS.0000000000005676
» https://doi.org/10.1097/PRS.0000000000005676 -
39 Pradeep AR, Karvekar S, Nagpal K, Patnaik K, Raju A, Singh P. Rosuvastatin 1.2 mg in situ gel combined with 1: 1 mixture of autologous platelet-rich fibrin and porous hydroxyapatite bone graft in surgical treatment of mandibular class II furcation defects: A randomized clinical control trial. J Periodontol. 2016;87(1 ):5-13. https://doi.org/10.1902/jop.2015.150131
» https://doi.org/10.1902/jop.2015.150131 -
40 Gautam K, Kapoor A, Mathur S, Ali AR, Choudhary A, Shekhawat A. Comparative evaluation of autogenous bone graft and autologous platelet-rich fibrin with and without 1.2 mg in situ rosuvastatin gel in the surgical treatment of intrabony defect in chronic periodontitis patients. Contemp Clin Dent. 2022;13(1):69. https://doi.org/10.4103/ccd.ccd_740_20
» https://doi.org/10.4103/ccd.ccd_740_20

 Cicatrização de feridas em coelhos com biomateriais autólogos associados à rosuvastatina
Cicatrização de feridas em coelhos com biomateriais autólogos associados à rosuvastatina