DOI:
10.1590/1809-6891v20e-35197
ZOOTECNIA
INFLUÊNCIA DOS NÍVEIS DE CO2 E DO TIPO DE INCUBADORA SOBRE O DESEMPENHO ZOOTÉCNICO E MORFOMETRIA CARDÍACA DE FRANGOS DE CORTE
INFLUENCE OF CO2 LEVELS AND TYPE OF INCUBATOR ON THE PERFORMANCE OF BROILERS
Jovanir Ines Muller Fernandes1* ORCID -
http://orcid.org/0000-0001-8722-7424
Anete Rorig1 ORCID - http://orcid.org/0000-0002-2753-4956
Camila de Souza Oro1 ORCID - http://orcid.org/0000-0003-4355-9288
Daiane Horn1 ORCID - http://orcid.org/0000-0002-7012-2893
Heloísa Laís Fialkowski Bordignon1 ORCID - http://orcid.org/0000-0001-7700-7073
Janaína Furlanetto de Mello2 ORCID - http://orcid.org/0000-0001-8234-6483
1Universidade Federal do Paraná, Curitiba, PR,
Brasil.
2Universidade Estadual de Maringá, Maringá, PR, Brasil.
*Autor para correspondência - jimfernandes@ufpr.br
Resumo
O objetivo do trabalho foi avaliar incubadoras de estágio múltiplo e único
e diferentes níveis de CO2 sobre o desempenho, número e
diâmetro das fibras musculares, morfometria cardíaca e rendimento de
carcaça de frangos de corte. Foram incubados 2.520 ovos férteis em um
delineamento inteiramente ao acaso, distribuídos em quatro níveis de CO2
(4.000, 6.000, 8.000 e 10.000ppm) em incubadoras de estágio único durante
os primeiros dez dias de incubação e um tratamento controle utilizando uma
incubadora de estágio múltiplo, totalizando cinco tratamentos com 504 ovos
em cada um. Após a eclosão, 1.050 pintos machos foram alojados de acordo
com o delineamento utilizado no incubatório. A hipercapnia aplicada nos
primeiros 10 dias de incubação afetou o ganho de peso e a conversão
alimentar dos pintos na primeira semana de vida, no entanto, esses efeitos
não foram mantidos até o final do período de criação. Não houve efeito de
incubadoras ou da hipercapnia sobre a morfometria muscular e cardíaca.
Houve maior rendimento de coxas das aves na idade de abate oriundas de
incubadoras em estágio único com até 6.000 ppm de CO2, quando
comparadas à incubação em máquinas de estágio múltiplo. Esse efeito pode
ser atribuído à maior vascularização induzida pela hipercapnia precoce.
Palavras-chave: desempenho produtivo, embrião, hipercapnia,
hipóxia.
Abstract
The aim of this work was to assess single and multiple-stage incubators
and different CO2 levels over performance, number and diameter
of muscle fibers, cardiac morphometry and carcass yield of broilers. Two
thousand five hundred and twenty fertile eggs were randomly allocated and
distributed into four different CO2 levels (4,000, 6,000, 8,000
and 10,000ppm) during the first ten days of incubation. After hatchling,
1,050 male chicks were placed into an experimental barn following the
design used in the hatchery. Induced hypercapnia during the first ten days
affected weight gain and feed conversion ratio of one-week-old chicks.
However, these aspects did not last until the end of the rearing period.
There was no effect of either hatchers or hypercapnia on number and
diameter of muscle fibers and cardiac morphometry. Higher thigh yield was
noted in the birds from single-stage incubators up to 6,000ppm of CO2.
This fact is explained through higher vascularization caused by premature
hypercapnia.
Keywords: embryo, hypercapnia, hypoxia, performance.
Recebido em:26 de abril de 2015.
Aceito em: 07 junho de 2018
Introdução
Devido aos avanços tecnológicos em toda a cadeia avícola e ao progresso genético dos últimos anos, índices de melhor conversão alimentar, conformação e rendimento de carcaça são atingidos, ano a ano, em menor tempo. O período de criação das aves foi reduzido para cerca de seis semanas, assim, o processo de incubação que tem duração de três semanas passa a representar grande parte da vida dos frangos de corte, o que enfatiza a sua importância sobre o desenvolvimento embrionário e o desempenho pós-eclosão(1).
O uso de máquinas de incubação de estágio múltiplo trouxe vantagens em termos de funcionamento e economia de energia, além de ser capaz de melhorar os resultados zootécnicos do incubatório, o que justifica o aumento na instalação dessas máquinas nas últimas décadas. Por outro lado, na incubação em estágio único, a máquina é carregada completamente a cada ciclo, sendo que o sistema tem um programa que permite alterações na temperatura, ventilação e umidade, o que não é possível nas incubadoras de estágio múltiplo(2).
As incubadoras de estágio único são uma evolução do estágio múltiplo e permitem manter constante a perda de umidade, ajustar as trocas gasosas em relação à qualidade da casca do ovo, conservando a temperatura ótima do embrião para a adequada atividade metabólica e ainda melhorar a condição sanitária da incubação, fatores que condicionam e maximizam a qualidade do desenvolvimento embrionário(2).
Essas incubadoras permitem ainda um controle sobre o nível de CO2, que é de grande importância no processo de incubação e vem sendo estudado devido a sua relação com o processo de vascularização no embrião. Estudos sobre máquinas de estágio único mostraram que altas concentrações de CO2 durante os primeiros dez dias de incubação podem melhorar o desempenho do embrião e resultar em efeitos benéficos sobre o crescimento das aves(3,5).
Everaert et al.(4) estudaram os maiores níveis deCO2 na segunda metade do período de incubação e não encontraram diferenças significativas em relação ao peso vivo de pintos de sete dias de idade. No entanto, outros estudos demonstraram que altas concentrações de CO2 na incubadora, durante os primeiros dez dias de incubação, resultaram em aumento do peso dos embriões e em redução do intervalo entre eclosões(5).
A indução da hipercapnia, pela elevação das concentrações de CO2, deve ocorrer durante a formação da membrana corioalantoide (5º a 11º dias de incubação), fase em que ocorre intensa angiogênese, o que pode influenciar o aumento da rede vascular da membrana corioalantoide e permitir maior difusão de oxigênio ao embrião nas fases posteriores do desenvolvimento(4, 5). O aumento da rede vascular dos ovos incubados sob condições de hipercapnia(6, 7) pode ser atribuído a um pH mais baixo no albúmen. Baixos níveis de pH têm efeito estimulatório sobre a expressão dos fatores do crescimento vascular VEGFe bFGF, os principais reguladores da angiogênese na membrana corioalantoide(3, 7).
Devido à maior representatividade do crescimento do tecido muscular em relação ao coração e pulmões, ocorre um déficit de oxigênio para atender às exigências metabólicas, resultando em quadros de ascite ou culminando em altas de mortalidade no período que antecede o abate dos frangos(5, 8, 9). Embriões expostos a altos níveis de CO2 durante a incubação apresentaram menor incidência de ascite na fase de crescimento(9, 10). Portanto, a manipulação dos parâmetros de incubação pode influenciar as respostas fisiológicas e metabólicas do embrião e contribuir com o melhor desempenho zootécnico pós-eclosão.
O objetivo do trabalho foi comparar a eficiência de máquinas de estágio múltiplo e único e diferentes níveis de CO2 sobre o desempenho, morfometria cardíaca e das fibras musculares e rendimento de carcaça de frangos de corte.
Material e métodos
A primeira fase do experimento foi realizada em uma cooperativa da região oeste do Paraná, e a segunda fase foi conduzida no Aviário Experimental da Universidade Federal do Paraná - Setor Palotina. Todos os procedimentos de criação dos animais e de coleta de material biológico foram aprovados pelo Comitê de Conduta Ética no Uso de Animais em Experimentação (número do protocolo de aprovação do Comitê de Ética: 05/2012).
Foram incubados 2.520 ovos férteis em um delineamento inteiramente ao acaso, distribuídos em quatro níveis de CO2 (4.000, 6.000, 8.000 e 10.000 ppm) em quatro incubadoras de estágio único (EU) e um tratamento controle utilizando uma incubadora de estágio múltiplo (EM), totalizando cinco tratamentos com 504 ovos em cada um. As incubadoras de estágio único permaneceram com taxa de ventilação reduzida pelo fechamento do damper até o momento em que fossem alcançados os níveis pretendidos de CO2 para cada incubadora, de forma gradativa e crescente. A partir de então, os níveis de CO2 foram mantidos até o 10º dia do período de incubação e, após esse período, todos os ovos foram submetidos ao mesmo nível de CO2 (4000 ppm). Na incubadora de estágio múltiplo, as concentrações de CO2 se mantiveram entre 3000 e 5000 ppm, de acordo com os parâmetros utilizadas pelo incubatório comercial onde o experimento foi realizado.
Após a eclosão, a seleção e a sexagem, 1.050 pintos Cobb machos foram alojados no aviário experimental da Universidade Federal do Paraná - Setor Palotina. Os tratamentos foram os mesmos utilizados na fase de incubação, distribuídos em 7 repetições, totalizando 35 unidades experimentais em um total de 30 aves por repetição. Água e ração foram fornecidas ad libitum durante todo o período de criação. O programa nutricional e a formulação das dietas, à base de milho e farelo de soja, seguiram as recomendações nutricionais adotadas pelas integrações avícolas da região. Aos 7 e 42 dias de idade, todas as aves de cada unidade experimental e as sobras de ração foram pesadas para a determinação do ganho de peso corporal, consumo de alimento e conversão alimentar.
Aos 42 dias de idade, duas aves de cada repetição (14 amostras/tratamento) foram abatidas. Para o cálculo de rendimento de carcaça, foi considerado o peso da carcaça eviscerada quente, sem os pés, cabeça e gordura abdominal, em relação ao peso vivo que foi obtido individualmente antes do abate das aves. Para o rendimento dos cortes nobres, foi considerado o rendimento do peito inteiro com pele e ossos e das pernas (coxa e sobrecoxa com ossos e pele), que foi calculado em relação ao peso da carcaça eviscerada. A gordura abdominal presente ao redor da cloaca, da bolsa cloacal, da moela, do proventrículo e dos músculos abdominais adjacentes foi retirada. Em seguida, foi pesada e também calculada em relação ao peso da carcaça eviscerada.
Das mesmas aves, foram obtidas amostras do músculo Pectoralis major direito, as quais foram imediatamente congeladas em nitrogênio líquido e mantidas em freezer (80ºC) até o processamento. Para o processamento do material colhido, os segmentos musculares foram transferidos para a câmara do criostato, orientados para a obtenção de cortes transversais das fibras, com oito micras de espessura e submetidos à coloração de Hematoxilina-Eosina. A captura de imagens para análise morfométrica foi realizada por meio de câmera digital de alta resolução PRO SERIES da Mídia Cibertecnics, acoplada ao microscópio OlimpusBx 40. Para a leitura das imagens, foi utilizado um analisador de imagem computadorizado IMAGE PROPLUS 5.2, da Mídia Cibertecnics. Foram analisados 10 campos por lâmina para o cálculo do número de fibras do músculo e os diâmetros das fibras.
O coração de cada carcaça foi removido, pesado e cortado transversalmente logo abaixo das valvas atrio-ventriculares direita e esquerda. Foi utilizada uma lupa acoplada a um estereomicroscópio para a captura das imagens da secção transversal de cada coração. Para a leitura das imagens, utilizou-se o mesmo sistema descrito para as medidas das fibras musculares. Foram mensuradas a espessura da parede da câmara cardíaca direita (EPCCD), a espessura da parede da câmara cardíaca esquerda (EPCCE), o septo ventricular (SV) e a circunferência cardíaca (CC).
Os resultados obtidos foram tabulados e analisados utilizando-se a análise de variância (ANOVA) do procedimento General Lineal Model (GLM), com auxílio do programa estatístico SAS (2002, SAS Institute Inc., Cary, NC). Os contrastes das médias dos tratamentos foram obtidos pelo teste de Dunnett ao nível de 5% de significância, utilizando a incubação em estágio múltiplo como testemunha. O efeito dos níveis de CO2 das incubadoras de estágio único foi testado por análise de regressão polinomial.
Resultados
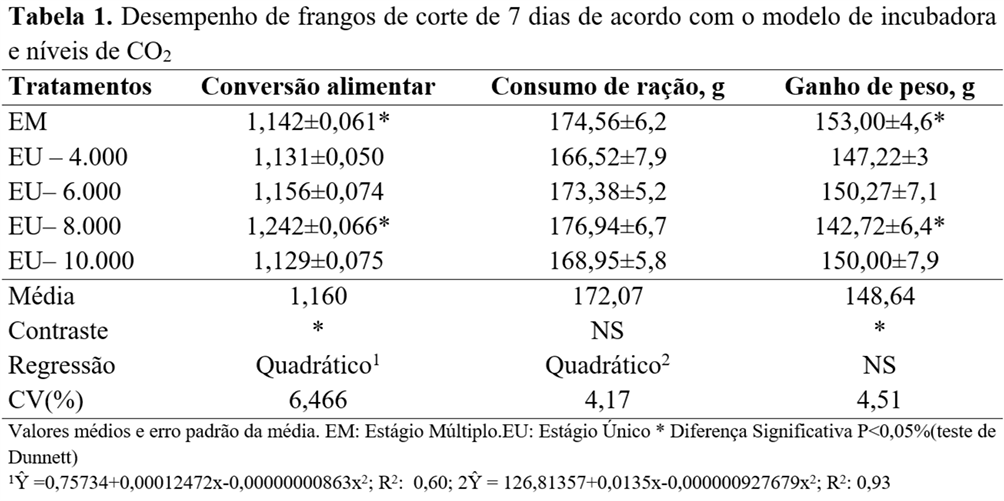
No final da primeira semana de idade, houve melhor (P<0.05) conversão alimentar e ganho de peso dos pintainhos incubados em EM quando comparados com a incubação em EU e 8.000 ppm de CO2. Por outro lado, na avaliação do efeito dos níveis de CO2 em incubadoras EU, verificou-se efeito quadrático sobre a conversão alimentar e consumo de ração. A pior taxa de conversão alimentar foi obtida com o nível de 7.226 ppm de CO2, enquanto o maior consumo de ração, com o nível de 7.292 ppm (Tabela 1).
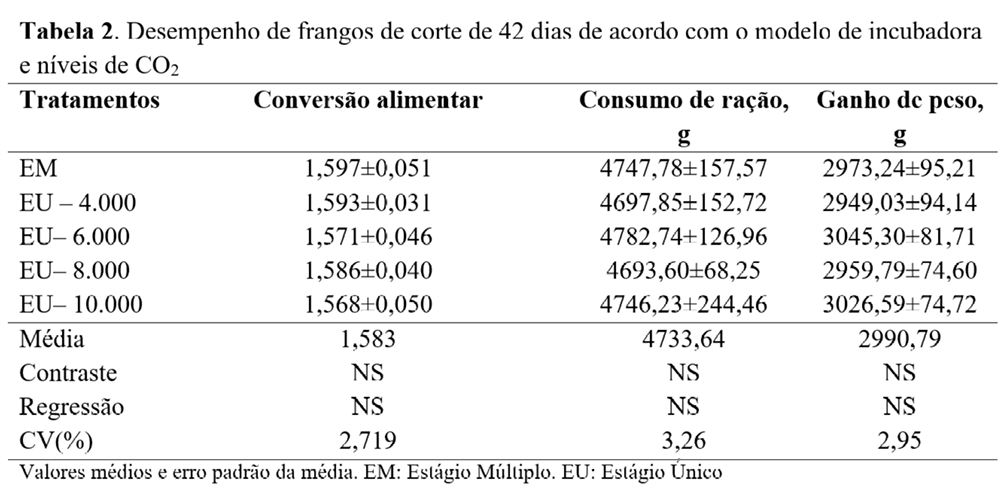
Aos 42 dias, tanto na análise de contraste (incubadora EM vs incubadora EU) quanto na análise de regressão dos níveis de CO2, não foram observadas diferenças significativas (Tabela 2).
Não foram observadas diferenças (P<0,05) para o número ou diâmetro das fibras musculares em função dos sistemas de incubação ou níveis de CO2 aos 7 e 42 dias (Tabela 3). Da mesma forma, os tratamentos não influenciaram (P>0,05) as medidas de morfometria cardíaca descritas na Tabela 4.
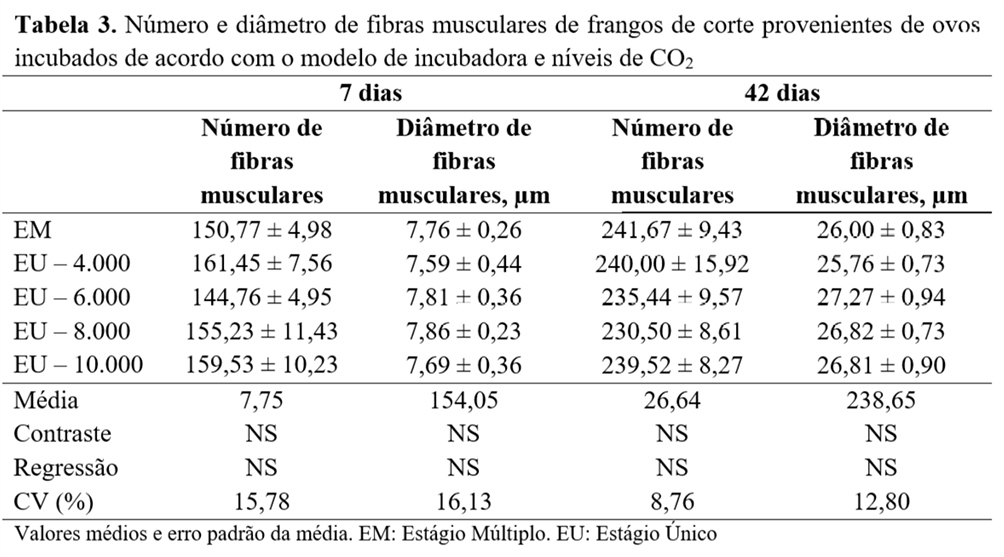
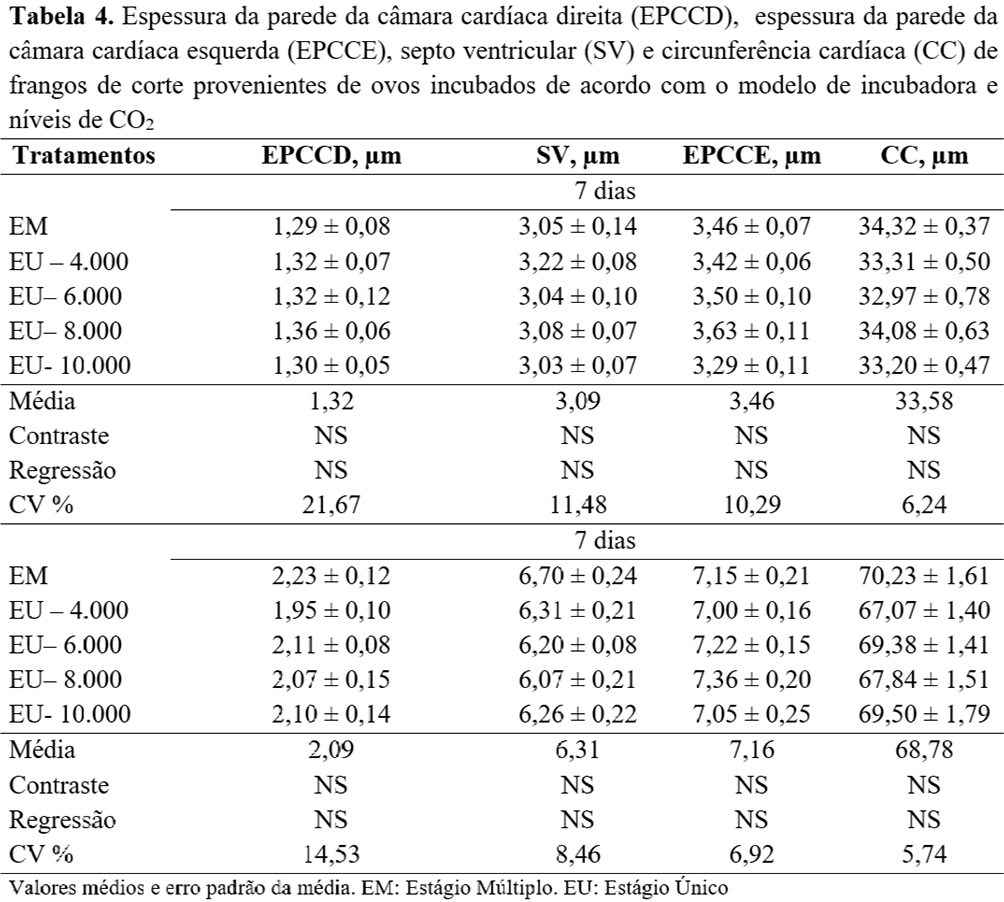
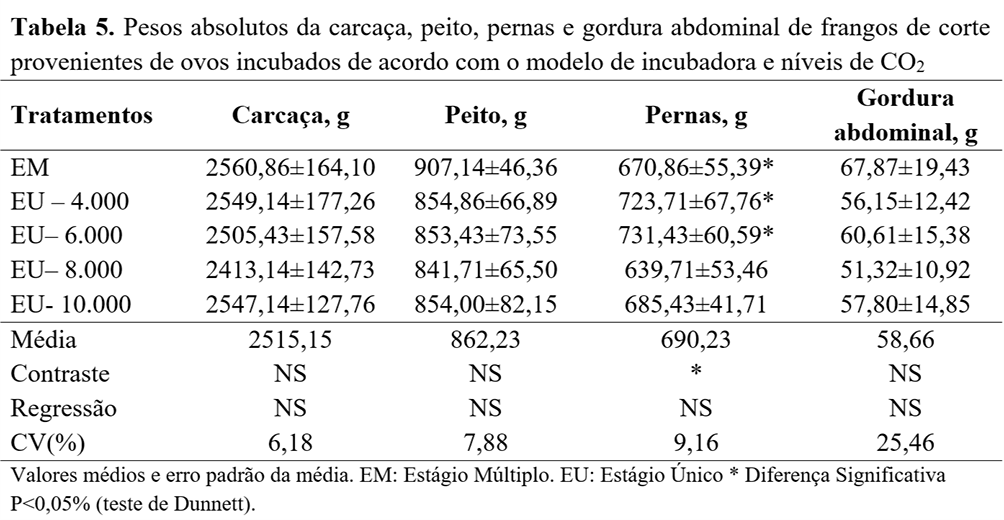
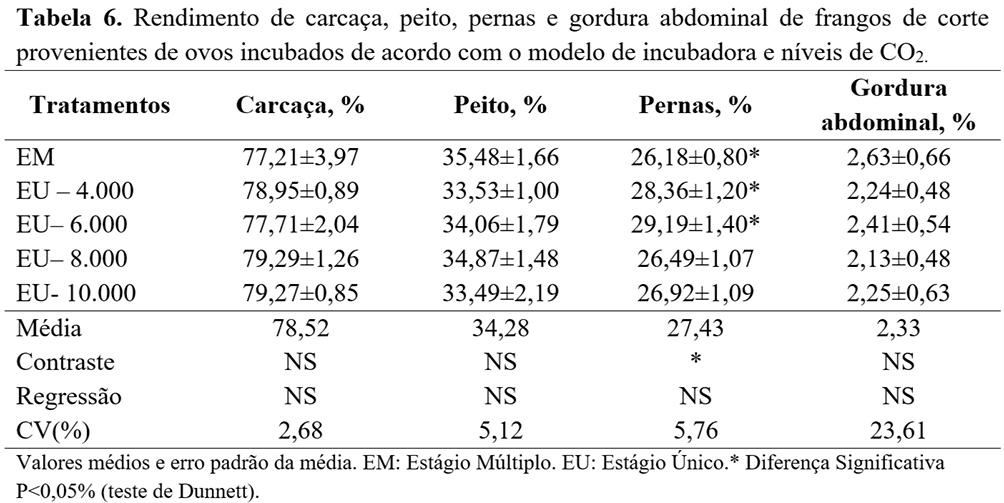
Para o rendimento absoluto de carcaça e cortes comerciais, não foram observadas diferenças (P>0,05) (Tabela 5). Entretanto, observou-se diferença apenas no peso e no rendimento de coxa, que foi maior (P<0,05) nas aves provenientes dos ovos incubados com níveis de CO2 de 4.000 e 6.000 ppm, em comparação com a aves incubadas em máquinas EM (Tabela 6).
Discussão
Após a postura, o dióxido de carbono é dissipado gradativamente do ovo e, se o período entre postura e incubação for estendido, esse processo é intensificado, podendo levar ao aumento excessivo do pH, prejudicando o desenvolvimento embrionário. Desse modo, alguns estudos vêm demonstrando que a utilização de maiores níveis de CO2 durante a incubação pode contribuir positivamente com a formação vascular do ovo embrionado(5, 6, 7), resultando em neonatos de melhor qualidade(6), e ainda influenciar os mecanismos adaptativos no embrião, tornando-os mais resistentes aos fatores estressores do período pós-eclosão(4,11,12).
No ambiente de desenvolvimento embrionário, a interação embrião-ambiente é explicada muitas vezes pelo termo "adaptação epigenética"(13), que nada mais é do que um mecanismo de ajuste do embrião a pequenas variações de tempo no ambiente do desenvolvimento embrionário, que induzem a variações na expressão gênica, apresentando fenótipos diferentes com maior tolerância diante das diferentes condições ambientais e de manejo durante a fase pós-eclosão. A exposição do embrião a curtos períodos de baixa ou alta temperatura e níveis moderados de O2 e CO2(14, 15) estão entre os fatores desencadeadores dessa condição.
Os resultados deste estudo mostram que frangos incubados em máquinas de estágio múltiplo apresentaram melhor conversão alimentar e maior ganho de peso, quando comparados com frangos provenientes de ovos incubados com 8.000 ppm de CO2 durante os primeiros 10 dias de incubação.
Além disso, observou-se que os níveis de CO2, entre 6.000 ppm e 8.000 ppm, resultaram em pior conversão alimentar. Esses resultados contrastam com os encontrados por Everaert et al.(4), que não encontraram diferença no desempenho aos 7 dias de pintainhos provenientes de ovos submetidos à hipercapnia na segunda metade da incubação. Por outro lado, Buyset al.(10) constataram peso mais elevado aos 21 dias em frangos incubados em elevadas concentrações de CO2. Esse resultado foi confirmado por Everaertetal.(12), apesar de aos 28, 35 e 42 dias os frangos oriundos de incubação em condições padrão apresentarem peso superior.
A hipercapnia precoce pode ser responsável pela ativação de genes envolvidos na secreção de enzimas ou hormônios, que atuam diretamente sobre a curva de crescimento dos frangos de corte(16). Estudos prévios descreveram correlação positiva entre nível de CO2 durante a incubação e nível de corticosterona e T4 aos 7 dias de idade(4), hormônios estes que têm ação direta sobre a taxa metabólica dos animais. Buys et al.(10) obtiveram menor nível plasmático de T3 em frangos incubados com alta concentração de CO2 e maior de T4 durante as 4 primeiras semanas de vida.
Porém, resultados diferentes foram encontrados por Everaert et al.(12), que relataram maior nível de T3 e T4, em todas as idades avaliadas, apenas no grupo controle.
Ainda são escassos os estudos que relacionam os maiores níveis de CO2 na incubação com o desempenho até a idade ao abate e principalmente com o rendimento de carcaça e cortes das aves.
No presente estudo, verificou-se maior rendimento de coxa nos frangos provenientes de ovos incubados com 4.000 e 6.000 ppm de CO2 em EU, quando comparados com a incubação em EM.
Este resultado pode ser atribuído ao fato de a maior vascularização ser ocasionada pela hipercapnia precoce.
Níveis de CO2 são capazes de aumentar a fração vascular da membrana corioalantoide do ovo(6, 17), o que pode refletir em maior vascularização ou no tipo e no tamanho das fibras musculares. O músculo do peito (Pectoralis major) é composto por fibras de contração rápida e glicolíticas, já o músculo das pernas (Sartorius) é do tipo misto, ou seja, de contração lenta e oxidativa e contração rápida e glicolíticas(18, 19). O número de fibras musculares é determinado por fatores genéticos e ambientais, os quais são capazes de influenciar a miogênese durante a embriogênese(20). Essa diferenciação muscular origina a maior massa de tecido do organismo, correspondendo a aproximadamente 50% do peso corporal na maioria das espécies animais. Considerando que o maior componente do músculo são as fibras, deduz-se que a taxa de crescimento pós-eclosão de determinado músculo é determinada pelo número de fibras musculares e pela taxa de crescimento individual das fibras.
De fato, a análise da literatura sobre efeitos da hipercapnia sugere um padrão geral em que a maior vulnerabilidade à modificação fenotípica aparece no meio do desenvolvimento embrionário das aves no aviário. A formação da musculatura esquelética no período embrionário é controlada por uma rede complexa de fatores, os quais atuam no controle da atividade de genes que codificam proteínas musculares, bem como daqueles que regulam negativamente o processo de formação do tecido muscular esquelético(21). A influência dos níveis de CO2 no processo de miogênese em frangos de corte ainda não foi esclarecida. Mais estudos nessa área podem torna real a possibilidade de manipulação na fase embrionária, visando a benefícios como o aumento do número de fibras musculares e/ou a melhora da qualidade da carne.
A avaliação morfométrica do coração das aves no presente estudo não mostrou nenhuma diferença em relação ao processo de incubação ou níveis de CO2. De acordo com estudos realizados por Zhang e Burggren(22), quando comparado com o mesmo peso do embrião, o peso do coração apresentou-se maior em pintainhos provenientes de ovos incubados sob condições de hipóxia, quando comparados aos que foram incubados em condições normais (21% de O2).
Embriões incubados em altitudes elevadas têm uma maior produção de CO2, indicando ao organismo a necessidade de um aumento no consumo de oxigênio, estimulando uma melhoria na eficácia da liberação do oxigênio da hemoglobina. Nessas condições, Hassanzadeh et al.(23) observaram menor hipertrofia ventricular direita nas aves e menor índice de ascite em relação às submetidas ao processo de incubação em baixa altitude.
A literatura contém informações conflitantes sobre o efeito da hipóxia no peso relativo do coração, como o aumento(24, 25), sem alteração(26) ou ainda a redução do peso relativo(23, 27). Nesse cenário, é importante considerar que tanto a hipercapnia quanto a hipóxia, precoce e tardia, são fenômenos diferentes, relacionados a processos fisiológicos e de desenvolvimento que podem resultar em alterações pós-eclosão distintas. Cabem à pesquisa científica o estudo e a compreensão de como podem ser aplicados para o máximo ganho em produtividade e rentabilidade da cadeia produtiva de frangos de corte.
Conclusão
O modelo de incubadora e os níveis de hipercapnia aplicados nos primeiros 10 dias de incubação afetaram o ganho de peso e a conversão alimentar dos pintos na primeira semana de vida. No entanto, esses efeitos não foram mantidos até o final do período de criação.
A morfometria cardíaca não foi alterada pela hipercapnia ou pelo modelo de incubadora. Houve maior rendimento de coxas das aves na idade de abate oriundas de incubadoras em estágio único com até 6.000 ppm de CO2, quando comparadas à incubação em máquinas de estágio múltiplo.
Referências
1 Druyan S. The effects of genetic line (broilers vs.
layers) on embryo development. Poultry Science. 2010;89(7):1457-1467.
2 Molenaar R, Reijrink IAM, Meijerhof R, Van Der Brand H. Meeting
embryonic requirements of broilers throughout incubation: A review.
Brazilian Journal of Poultry Science.2010;12(3):137-148.
3 Mueller CA, Tazawa H, Burggren WW. Dynamics of acid-base metabolic
compensation and hematological regulation interactions in response to CO2
challenges in embryos of the chicken (Gallus gallus). Journal of
Comparative Physiology B. 2014;184:641-649.
4 Everaert N, Kamers B, Witters A, De Smit L, Debonne M, Decuypere E,
Bruggeman V. Effect of Four Percent Carbon Dioxide During the Second Half
of Incubation on Embryonic Development, Hatching Parameters, and Posthatch
Growth. Poultry Science. 2007;86: 372-1379.
5 De Smit L, Bruggeman V, Debonne M, Tona JK, Kamers B, Everaert N,
Witters A, Onagbesan O, Arckens L, De Baerdemaeker J and Decuypere E. The
effect of non-ventilation during early incubation on the embryonic
development of chicks of two commercial broiler strains differing in
ascites susceptibility. Poultry Science. 2008;87:551-560.
6 Fernandes JI, Bortoluzzi C,Schmidt JM, Scapini LB, Santos TC, Murakami
AE. Single stage incubators and Hypercapnia during incubation affect the
vascularization of the chorioallantoic membrane in broiler embryos.
Poultry Science. 2017; 96:220-225.
7 Druyan S, Levi E, Shinder D and Stern T. Reduced O2
concentration during CAM development-Its effect on physiological
parameters of broiler embryos. Poultry Science. 2012;91:987-997.
8 Havenstein GG, Ferket PR and Qureshi MA.Carcass composition and yield of
1957 versus 2001 broilers when fed representative 1957 and 2001 broiler
diets. Poultry Science.2003;82:1509-1518.
9 Decuypere E, Buyse J, Buys N. Ascites in broiler chickens: Exogenous and
endogenous structural and functional causal factors. World's Poultry
Science Journal. 2000; 56: 367-377.
10 Buys N, Dewil E, Gonzales E & Decuypere E. Different CO2 levels
during incubation interact with hatching time and ascites susceptibility
in two broiler lines selected for different growth rate. Avian Pathology.
1998;27: 605-612.
11 Van de Ven LJF, Van Wagenberg AV, Decuypere E, Kemp B, Van den Brand H.
Perinatal broiler physiology between hatching and chick collection in 2
hatching systems. Poultry Science. 2013; 92:1050- 1061.
12 Everaert N, Willemsen H, Debonne M, Witters A, Kamers B, Darras VM, De
Baerdermaeker J, Decuypere E and Bruggeman V. Interaction betweeb ascites
susceptibility and CO2 during the second half of incubation of
two broiler lines: the effect on post-hatch development and ascites
motality. British Poultry Science.2012; 53: 262-269.
13 Gilbert S F & Epel D. Ecological Developmental Biology: integrating
epigenetics, medicine and evolution. Sinauer Associates Inc.
Sunderland.MA. USA. 2009; ISBN 978-0-87893-299-3. p.462.
14 Boleli, IC, Morita, VS, Matos Jr, JB, Thimotheo, M, & Almeida,
VR.Poultry Egg Incubation: Integrating and Optimizing Production
Efficiency. Revista Brasileira de Ciência Avícola. 2016;18:1-16.
15 Nichelmann M. Activation of thermoregulatory control elements in
precocial birds during the prenatal period. Journal of Thermal Biology.
2004;29:621-627.
16 De Smit L, Bruggeman V, Tona JK, Debonne M, Onagbesan O, Arckens L, De
Baerdemaeker J and Decuypere E. Embryonic developmental plasticity of the
chick: Increased CO2 during early stages of incubation changes
the developmental trajectories during prenatal and postnatal growth.
Comparative Biochemistry and Physiology Part A: Molecular &
Integrative Physiology. 2006;145:166-175.
17 Verhoelst E, Ketelaere B, Bruggeman V, Villamor E, Decuypere E,
Baerdemaeker J. Development of a fast, objective, quantitative methodology
to monitor angiogenesis in the chicken chorioallantoic membrane during
development. The International journal of developmental biology. 2011;55:
85-92.
18 Peter JB, Barnard RJ, Edgerton VR. Metabolic profiles of three fiber
types of skeletal muscle in Guinea pig and
rabbits.Biochemistry.1972;11(10): p.2672-2633.
19 Banks, W. J. Tecido muscular. In: Histologia veterinária aplicada. 2.
ed. São Paulo: Manole, 1992. cap. 13, p. 215-236.
20 Rehfeldt C, FiedlerI, Dietl G, and Ender K. Myogenesis and postnatal
skeletal muscle cell growth as influenced by selection. Livestcok
Production Science.2000;66:177-188.
21 Griffin, J., N. St-Pierre, M. S. Lilburn, and M. Wick. 2016. Temporal
embryonic transcription of chicken fast skeletal myosin heavy chain
isoforms in the single comb white leghorn. Poultry Science. 95:1151-1155.
22 Zhang H and BurggrenWW. Hypoxic level and duration differentially
affect embryonic organ system development of the chicken (Gallus gallus).
Poultry Science.2012; 91:3191-3201.
23 Hassanzadeh M, Bozorgmehri F, Buyse J, Bruggeman V, Decuypere, E.
Effect of chronic hypoxia during embryonic development on physiological
functioning and on hatching and post-hatching parameters related to
ascites syndrome in broiler chickens. Avian Pathology.2004;33(6):558-564.
24 Rouwet EV, Tintu AN, Schellings MWM, van Bilsen M, Lutgens E, Hofstra
L, Slaaf DW, Ramsey G, Noble FAC. Hypoxia induces aortic hypertrophic
growth, left ventricular dysfunction, and sympathetic hyperinnervation of
peripheral arteries in the chicken embryo. Circulation. 2002;
105:2791-2796.
25 Andrewartha S, Tazawa H, Burggren, WW. Acute regulation of hematocrit
and acid-base balance in chicken embryos in response to severe intrinsic
hypercapnic hypoxia. Respiratory Physiology & Neurobiology.
2014;195:1-10.
26 AltimirasJ, Phu L. Lack of physiological plasticity in the early
chicken embryo exposed to acute hypoxia. Journal of Experimental Zoology.
2000;286:450-456.
27 RuijtenbeekK, Noble FAC, Janssen GMJ, Kessels CGA,Fazzi GE, Blanco CE,
De Mey JGR. Chronic Hypoxia Stimulates Periarterial Sympathetic Nerve
Development in Chicken Embryo. Circulation. 2000;102:2892-2897.