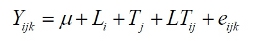
PRODUÇÃO
ANIMAL
COMPOSIÇÃO CORPORAL DE LINHAGENS DE TILÁPIA DO NILO (Oreochromis
niloticus) EM DIFERENTES CLASSES DE COMPRIMENTO
Vander Bruno
Santos1, Telma Reginato Martins2, Rilke Tadeu Fonseca
Freitas3
RESUMO
BODY COMPOSITION OF NILE
TILAPIAS (Oreochromis niloticus) IN
DIFFERENT LENGTH CLASSES
ABSTRACT
The objective of this
research was to evaluate the body composition of Nile tilapias in different
length classes of Thai and Commercial strains, being the latter derived from
the GIFT program (Genetically Improved Farmed Tilapia) on the levels of moisture,
crude protein, ether extract, ash and energy. The fish were cultivated in cages
in a dam in
KEYWORDS: chemical composition; GIFT; lipids; protein;
Thai.
INTRODUÇÃO
A qualidade da carne da tilápia e o seu crescimento acelerado são os
principais fatores que têm motivado maior interesse de produtores e
consumidores por essa espécie. A busca por linhagens de tilápias de desempenho
superior, cada vez mais frequente entre os produtores, aliada à procura cada
vez maior de alimentos saudáveis, entre a população de todo o mundo, têm
demandado avaliações desses peixes cultivados em nossos ambientes.
As tilápias da linhagem Chitralada (Tailandesa) e aquelas oriundas do
programa GIFT (Genetically Improved
Farmed Tilapia) estão sendo amplamente difundidas em nossos ambientes, pois
têm demonstrado crescimento mais acelerado quando comparadas à comum. Isso pode
afetar as qualidades de carcaça e de carne em relação à dinâmica das
concentrações de proteínas e lipídios.
A tilápia Tailandesa foi desenvolvida no Japão e melhorada no Palácio Real
de Chitralada, na Tailândia. Essa linhagem foi introduzida no Brasil em
Existem linhagens introduzidas no mercado brasileiro oriundas do maior
programa de melhoramento genético de tilápias, o Genetically Improved Farmed Tilapia (GIFT), que foi executado nas
Filipinas (ZIMMERMANN, 2003). O programa GIFT envolveu quatro linhagens
silvestres de tilápias, capturadas em 1988-1989, no Egito, Gana, Quênia e
Senegal, e quatro linhagens confinadas, introduzidas nas Filipinas de
O crescimento caracteriza-se por um desenvolvimento harmônico de principais
tecidos, nomeados espinhas, músculo e tecido adiposo. O crescimento diferencial
desses tecidos provoca mudanças na composição química. Essas mudanças resultam
da estimulação ou da alteração do turnover
e da retenção de componentes químicos: proteínas, lipídios, carboidratos e
minerais, com desenvolvimento normal ou alterado dos específicos tecidos. Além
do mais, mudanças na composição desses componentes – classes de lipídios,
composição de ácido graxo, natureza e funcionalidade das proteínas – também ocorrem
com o crescimento e diferenciação dos tecidos (FAUCONNEAU et al., 1995).
A composição química corporal dos peixes pode ser afetada por alguns
fatores, incluindo espécies, condições ambientais, tamanho do peixe, nível de
proteína da dieta e taxa de alimentação (OGATA & SHEARER, 2000). Para a tilápia,
numerosos estudos mostram que a composição do corpo se aproxima da composição
da dieta, mas pouca informação tem sido gerada comparando a composição geral e
do filé de diferentes grupos genéticos (LUGO et al., 2003).
As principais categorias de componentes do corpo do peixe são as mesmas
daquelas de outros animais: água (com grande predominância), lipídio, proteína
e pequena quantidade de carboidratos e minerais (frequentemente designados
cinzas) que sobram depois que o corpo é queimado durante a calorimetria
(WEATHERLEY & GILL, 1987).
FAUCONNEAU et al. (1995) relataram que a porcentagem de
lipídio e de proteína e o conteúdo de energia aumentam, enquanto o conteúdo de
água diminuiu com o aumento do peso corporal.
O conteúdo de lipídio (% peso corporal) em peixes tende a aumentar com a
idade (e tamanho), declinar durante o inverno, na migração e na desova e
alcança o seu valor máximo no final do principal período de alimentação do ano.
Como um estoque energético, ele tende a estar na forma de gorduras neutras –
triglicerídeos. Fosfolipídios, ácidos graxos livres, esteróis etc. compreendem
somente uma pequena fração de lipídios (WEATHERLEY & GILL, 1987). Outro
fator que afeta o conteúdo de lipídios é a origem genética (FAUCONNEAU et al.,
1991).
SHUL’MAN (1974), apud WEATHERLEY & GILL (1987), notou que, em
contraste com a dinâmica de lipídios em peixes, a dinâmica do conteúdo de
proteínas é essencialmente indistinguível. Enquanto em peixes imaturos o crescimento
protéico ocorre no corpo como um todo, em peixes maduros ele está altamente
associado com o desenvolvimento gonadal. Em estudos com dourada (Spaurus
aurata), LUPATSCH et al. (2001) relataram que o nível protéico permaneceu
basicamente constante, entre 15,7% a 19%, mas grandes alterações ocorreram no
conteúdo de lipídios, de 5,5% a 21,0%, com o crescimento dos peixes.
Segundo WEATHERLEY & GILL (1987), o crescimento de peixes também é
governado pelo aumento na massa de escamas e tecido ósseo, que são altamente
compostos de substâncias inorgânicas (minerais). Entretanto, relativamente
pouca atenção tem sido dada à composição elemental inorgânica de peixes.
SHEARER (1984), estudando a composição elemental inorgânica durante o
crescimento de truta arco-íris, constatou que a concentração de alguns
elementos permanece constante enquanto outros aumentam ou diminuem linearmente
com o aumento do tamanho do peixe.
Os carboidratos têm sido geralmente ignorados, pois aparecem em pequena
porcentagem do peso do corpo (aproximadamente 0,5%), na forma de glicogênio
(WEATHERLEY & GILL, 1987).
Este estudo foi realizado com o objetivo de determinar a composição
corporal em diferentes classes de comprimento de tilápias do Nilo (Oreochromis
niloticus) da linhagen Chitralada (Tailandesa) e uma linhagem comercial
proveniente do programa GIFT, quanto aos teores de proteína bruta (PB), extrato
etéreo (EE), umidade (%U), cinzas e energia nas diferentes linhagens.
MATERIAL E MÉTODOS
Inicialmente, foram utilizados 500 alevinos da linhagem Tailandesa
(Chitralada) e 500 de uma linhagem comercial. A linhagem comercial, utilizada
neste trabalho, é derivada do programa GIFT, executado nas Filipinas e foi
nomeada linhagem “Comercial”. Os alevinos foram provenientes de uma população
monosexo masculina (tratada com 17a-metiltestosterona), pesando
aproximadamente 10g. Os peixes foram cultivados em quatro tanques-rede de
Os peixes foram alimentados duas vezes ao dia, com ração comercial contendo
32% de proteína bruta e um mínimo de 7% de extrato etéreo. A quantidade diária
foi fornecida de acordo com a biomassa dos tanques e a temperatura da água,
variando de 7% na primeira semana a 4% na última.
Semanalmente, dados limnológicos (oxigênio, pH, transparência e
alcalinidade) do ambiente de cultivo foram coletados utilizando-se kit técnico
comercial de análises de água, sendo realizados no início da manhã (8:00 horas)
e à tarde (14:00 horas).
Durante o período de cultivo, foram feitas três amostragens de 40 peixes de
cada linhagem, os quais foram insensibilizados por choque térmico e abatidos
(anóxia), após terem passado por um período de jejum de 48 horas. Os peixes
foram pesados e medidos em comprimento. O comprimento foi medido da extremidade
anterior da cabeça até o pedúnculo, desconsiderando-se a nadadeira caudal.
Por ocasião das amostragens, foram coletadas 18 amostras, compostas por
peixes compreendidos nas classes de comprimento de 5-10cm, 10-15cm e 15-20cm.
Cada classe de comprimento foi composta por seis amostras de, aproximadamente,
150g de peixe para cada linhagem.
As amostras foram congeladas, moídas e homogeneizadas para determinação da
umidade (U), extrato etéreo (EE), proteína bruta (PB) e cinzas de acordo com a Association of Official Analytical Chemists,
AOAC (1995). A determinação de carboidratos foi realizada por meio de cálculo
por diferença, segundo Silva &
Queiroz (2002):
%CHO = 100 - %U - %EE - %PB - %cinzas
A quantidade de energia foi calculada tomando-se como base a energia
metabolizável de carboidratos, gordura e proteína. Considerou-se o somatório do
produto do teor de proteínas por quatro, do teor de lipídios por nove e do teor
de carboidratos por quatro (SILVA & QUEIROZ, 2002).
O delineamento experimental foi inteiramente casualizado com os tratamentos
em esquema fatorial 2 x 3 (linhagem X classe de tamanho), com seis repetições.
Os dados obtidos foram analisados utilizando-se o seguinte modelo estatístico:
em que
μ: média geral;
Yijk: observação k da linhagem i na classe de tamanho j;
Li: efeito da linhagem i, sendo i = 1, 2;
Tj: efeito da classe de tamanho j, sendo j = 1, 2, 3;
LTij: efeito da interação entre a linhagem i e a classe de comprimento j;
eijk: erro associado a cada observação que, por pressuposição, é NID (0,σ2).
Os dados obtidos foram comparados entre as linhagens, pelo teste F, a 5% de
significância e, para o efeito de classe de comprimento, aplicou-se o teste de
Tukey, a 5%. Para isso, foi utilizado o procedimento GLM, do pacote
computacional SAS para Windows versão 8.1.
RESULTADOS E DISCUSSÃO
A análise de variância mostrou efeito (P<0,05) da interação entre
linhagem e classe de tamanho para umidade, extrato etéreo, carboidratos e
energia. A porcentagem de cinzas mostrou efeito significativo do tamanho do
peixe, independentemente da linhagem. Por outro lado, a porcentagem de proteínas
não revelou nenhum efeito significativo (P>0,10), apresentando média de
10,12%.
Todos os desdobramentos das
interações mostraram efeito significativo do tamanho dos peixes em cada
linhagem de tilápia e de linhagem nas classes de tamanho 5-10cm e 10-15cm. Não
houve diferença entre as linhagens quanto à composição química na classe de
15-20cm. Os valores médios dos componentes químicos estão apresentados na
Tabela 1.
Pode-se observar, pelos dados
da Tabela 1, que os peixes na classe de menor comprimento (5-10cm) apresentaram
maior % de umidade e menor % de lipídios e energia (kcal/g), quando comparados
com os peixes das demais classes, e esse comportamento foi semelhante para as
duas linhagens de tilápias.
A linhagem Tailandesa não
apresentou diferença nos componentes químicos nas classes de 10-15 e de
15-20cm. Isso já não foi observado na linhagem Comercial, na qual peixes de
A linhagem Comercial apresentou maior porcentagem de umidade nas
classes de comprimento de 5-10cm e 10-15cm e menor na classe de 15-20cm quando
comparada com a Tailandesa. Isso indica maior redução na porcentagem de umidade
na linhagem Comercial com o crescimento dos peixes. A linhagem Tailandesa
apresentou decréscimo de 4,4%, enquanto a Comercial, decréscimo de 10,2% na
porcentagem de umidade de peixes na classe de comprimento de 5-10cm, quando
comparados com peixes de 15-20cm. Isso pode ser visualizado na Figura 1.
O conteúdo de extrato etéreo,
como indicativo do conteúdo de gordura, aumentou consideravelmente nos peixes
de 10-15cm, quando comparado aos peixes de 5-10cm e não foi diferente dos
peixes de 15-20cm. Esse acréscimo foi semelhante nas duas linhagens e mais
acentuado na Comercial do que na Tailandesa (153% e 96%, respectivamente).
Entretanto, a linhagem Tailandesa apresentou maior porcentagem de extrato
etéreo nos peixes de 5-10cm e 10-15cm do que a Comercial. Na classe de 15-20cm
não houve diferença entre as linhagens. Isso pode ser melhor visualizado na
Figura 2.
Neste trabalho, verificou-se uma relação inversa entre a porcentagem de
água e a de gordura. Isso tem sido observado em inúmeros trabalhos conduzidos
em peixes e parece haver uma consistência entre as diversas espécies que vivem
sob diferentes condições de alimentação, crescimento e desenvolvimento
reprodutivo (JOBLING et al., 2002).
As diferenças nas taxas de
crescimento, encontradas entre as linhagens Tailandesa e Comercial, sugerem
diferentes taxas metabólicas na mobilização de nutrientes que alteram a
composição centesimal, particularmente o conteúdo de água e lipídios
encontrados neste experimento. Ressalta-se que as duas linhagens foram
cultivadas com a mesma dieta, contendo níveis de proteína e lipídios
recomendados para esses peixes, na mesma qualidade de água.
O conteúdo proteico (%) não
apresentou alteração com o crescimento dos peixes e foi semelhante entre as
linhagens (Figura 3). SHEARER (1994)
afirma que o conteúdo proteico de salmonídeos em crescimento é determinado
somente pelo tamanho do peixe e não é afetado pela taxa de crescimento, dieta
ou fatores ambientais. O conteúdo proteico de muitas espécies de peixes aumenta
suavemente ou permanece mais ou menos estável com o aumento do peso do corpo
(RAMSEYER, 2002).
HEINSBROEK et al. (2007)
encontraram até mesmo diminuição no conteúdo proteico, com o aumento de tamanho
de enguias Anguilla anguilla. Essas informações explicam a falta de
significância do efeito do comprimento no conteúdo proteico das tilápias, encontrada
neste experimento.
Quanto à porcentagem de carboidratos, observou-se que não houve
alteração entre as diferentes classes de comprimento na linhagem Tailandesa, ao
passo que, na Comercial, os peixes da classe de 15-20cm apresentaram aumento de
55%, quando comparados com os das classes de 5-10 e 10-15cm (Figura 5). Esse
acréscimo com o crescimento dos peixes na linhagem Comercial e a diferença
encontrada em relação à Tailandesa pode estar associado a diferenças no
crescimento alométrico do tecido muscular dessas linhagens, uma vez que os
carboidratos encontrados correspondem basicamente ao glicogênio muscular. SANTOS
et al. (2006) encontraram
diferenças significativas no crescimento alométrico do filé nas linhagens Tailandesa
e Supreme, tendo a linhagem Supreme coeficiente alométrico positivo (b>1),
ou seja, o desenvolvimento do filé é proporcionalmente maior do que o corpo. Já
para a Tailandesa, o crescimento do filé foi isogônico (b=1), ou seja,
desenvolvimento proporcional ao corpo.
O ganho em biomassa (em peso vivo), em animais, é o resultado da
deposição de água, proteína, gordura, minerais e uma pequena quantidade de
outros componentes (glicogênio etc.). A quantidade de componentes depositados
por unidade de ganho de peso vivo não é constante, mas altera com o peso do
animal, o alimento utilizado, o estado fisiológico e outros fatores (BUREAU et
al., 2006). O conteúdo proteico de peixes permanece relativamente constante
entre os estágios de vida e é pouco afetado por fatores da dieta; o conteúdo de
lipídios do peixe é variável, dependendo do aporte de energia e do crescimento
(SHEARER, 1994).
A quantidade de energia
(kcal/g) aumentou com o crescimento dos peixes, nas duas linhagens. Esse
acréscimo foi de 32% na Tailandesa e 72% na Comercial. A linhagem Tailandesa
apresentou maior quantidade de energia nas classes de 5-10cm e 10-15cm, quando
comparada com a Comercial e, na classe de 15-20cm, não houve diferenças entre
elas. Nos peixes de 5-10cm, essa diferença foi da ordem de 22% e, nos peixes de
10-15, de 12%. Isso está ilustrado na Figura 6.
Carboidratos, proteína bruta
e lipídios contêm 17,2, 23,6 e 39,5 kJ/g de energia bruta, respectivamente.
Desde que o conteúdo de carboidratos é relativamente pequeno em peixes
(SHEARER, 1994), sua contribuição para o conteúdo de energia bruta do corpo
inteiro é desprezível. O conteúdo de energia de peixes é, portanto, dependente
da proteína bruta e dos lipídios (GUNTHER et al., 2005). Entretanto, nesse
experimento, o conteúdo de carboidratos foi de aproximadamente 5% e não poderia
ser desconsiderado.
Segundo WEATHERLEY & GILL
(1983), valores de conteúdo calórico obtidos a partir de calorimetria direta
foram maiores do que aqueles obtidos indiretamente dos valores de proteínas e
lipídios em trutas. Entretanto, mesmo desconsiderando a energia proveniente de
carboidratos, esses autores admitiram que as diferenças foram pequenas entre
essas formas de obtenção do conteúdo de energia.
No presente estudo, o
conteúdo de proteína se manteve basicamente constante com o aumento do
comprimento dos peixes e foi praticamente o mesmo nas linhagens de tilápias. Embora
o conteúdo de lipídios tenha apresentado interação significativa entre linhagem
e tamanho somente a 10% de significância, eles provavelmente foram os
responsáveis pelas diferenças encontradas no comportamento do conteúdo de
energia entre as linhagens nas diferentes classes de tamanho.
LUGO et al. (2003) compararam a
composição corporal de dois grupos genéticos de tilápias. Ambos foram
semelhantes, apresentando diferenças somente na composição do filé. Um exemplo
de diferenças significativas foi reportado por COOK et al. (2000), que
compararam o crescimento e a composição corporal de salmão do Atlântico (Salmo salar) transgênico e
não-geneticamente modificado. O genótipo transgênico obteve 2,62-2,85 vezes
maior crescimento que o genótipo não-transgênico, mas a composição corporal do
genótipo transgênico apresentou menor conteúdo de matéria, proteína, cinzas e
lipídios. A diferença no conteúdo de lipídio foi notável, com 2,84% no
transgênico e 5,57% no não-transgênico. A redução no conteúdo de proteínas e
lipídios no genótipo transgênico foi devida à sua maior taxa metabólica.
O fato de a linhagem
Tailandesa, aparentemente, apresentar maior conteúdo de lipídios nas primeiras
classes de comprimento, poderia sugerir um maior desenvolvimento de seu tecido
adiposo. Entretanto, a linhagem Comercial foi a que apresentou maior
hiperplasia e hipertrofia desse tecido. Na verdade, a massa corporal
correspondente ao tecido adiposo não foi estudada entre as linhagens e nem
mesmo o conteúdo de lipídios na carcaça, mas, visivelmente, a Tailandesa
apresentou maior quantidade de tecido adiposo visceral.
Simões et al. (2007) determinaram a composição físico-química
no filé de tilápias da linhagem Tailandesa encontrando moderados teores de
lipídios e elevados teores de proteínas, e caracterizaram a tilápia como
pescado com teor intermediário de gordura e de alto valor proteico. Signor et al. (2010) estudaram a adição
de complexo enzimático na ração de tilápias e encontraram melhor desempenho e
conversão alimentar, mas não encontraram efeitos sobre a composição da carcaça.
LUGO et al. (2003) concluíram que possível foco de estudos poderia ser a
avaliação de outros componentes corporais e características para determinar
elementos que poderiam auxiliar na proveitosa exploração de tilápias.
Entretanto, diversas análises devem ser realizadas, considerando principalmente
diferenças entre grupos genéticos.
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Official methods of analysis of the Association of Official Analytical
Chemists. 18.ed. Arlington, 1995. 2v.
BENTSEN, H. B.; EKNATH, A. E.; VERA, M. S. P.; DANTING, J. C.; BOLIVAR,
H. L.; REYES, R. A.; DIONISIO, E. E.; LONGALONG, F. M.; CIRCA, A. V.; TAYAMEN,
M. M.; GJERD, B. Genetic improvement of
farmed tilapias: growth performance in a complete diallel cross experiment with
eight strains of Oreochromis niloticus.
Aquaculture, Amsterdam, v. 160, n.
1/2, p. 145-173, 1998.
BUREAU, D. P.; HUA, K.; CHO, C. Y. Effect of feeding level on growth and
nutrient deposition in rainbow trout (Oncorhynchus mykiss Walbaum) growing
from 150 to 600g. Aquaculture Research, v. 37, p. 1090-1098, 2006.
COOK J. T.; MCNIVEN, M. A.; RICHARDSON, G. F.; SUTTERLIN, A. M. Growth rate, body composition and feed
digestibility/conversion of growth-enhanced transgenic Atlantic salmon (Salmo salar). Aquaculture, Amsterdam,v. 188, p. 15-32, 2000.
FAUCONNEAU, B.; ALAMI-DURANTE, H.; LAROCHE, M.; MARCEL, J.; VOLLT, D.
Growth and meat quality relations in carp. Aquaculture,
Amsterdam,v. 129, p. 265-297, 1995.
FAUCONNEAU, B.; CORRAZE, G.; LEBAIL, P.Y.; VERNIER, J. M. Lipid storage in fish: cellular, metabolic
and hormonal control. Inra, Production
Animal, v. 3, p. 369-381, 1991.
GUNTHER, S. J.; MOCCIA, R. D.; BUREAU, D. P. Growth and whole body composition of lake
trout (Salvelinus namaycush), brook trout (Salvelinus fontinalis)
and their hybrid, F1 splake (Salvelinus namaycush X Salvelinus
fontinalis), from first–feeding to 16 weeks post first-feeding. Aquaculture,
Amsterdam v. 249, p. 195–204, 2005.
HEINSBROEK L. T. N.; VAN HOOFF P. L. A.; SWINKELS W.; TANCK, M. W.T.;
SCHRAMA, J. W.; VERRETH, J. A. J.
Effects of feed composition on life history developments in feed intake,
metabolism, growth and body composition of European eel, Anguilla anguilla.
Aquaculture, Amsterdam, v. 267, p. 175–187, 2007.
LUGO, M. G.; ALVAREZ, I.
G.; NOVOA, M. A. O; CÓRDOVA, G. M. Comparison of
growth, fillet yield and proximate composition between Stirling Nile tilapia
(wild type) (Oreochromis niloticus,
Linnaeus) and red hybrid tilapia (Florida red tilapia X Stirling red O. niloticus) males. Aquaculture Research, v. 34, p.
1023-1028, 2003.
LUPATSCH, I.; KISSIL, G. WM.; SKLAN, D.; PFEFFER, E. Effects of varying dietary protein and energy
supply on growth, body composition and protein utilization in gilthead seabream
(Sparus aurata L.). Aquaculture Nutrition, v. 7, p. 71-80,
2001.
OGATA, H. Y.; SHEARER, K. D.
Influence of dietary fat and adiposity on feed intake of juvenile red
sea bream Pargus major. Aquaculture, Amsterdam v. 189, p.
237-249, 2000.
RAMSEYER, L. J. Predicting
whole-fish nitrogen content from fish wetweight using regression analysis. North
American Journal of Aquaculture, v. 64, p. 195–204, 2002.
SANTOS, V. B.; FREATO, T. A.; FREITAS, R. T. F.; LOGATO, P. V. R. Crescimento relativo e coeficientes alométricos do corpo
de linhagens de tilápias do Nilo. Ciência Animal Brasileira, Goiânia, v. 7, p.
357-364, 2006.
SHEARER, K. D. Changes in
elemental composition of hatchery-reared raibow trout, Salmo gairdneri, associated with growth and reproduction. Canadian Journal of Fish and Aquatic
Science, v. 41, p. 1592-1600, 1984.
SHEARER, K. D. Factors affecting
the proximate composition of cultured fishes with emphasis on salmonids. Aquaculture,
Amsterdam v. 119, p. 63– 88, 1994.
SHUL’MAN, G. E. Life Cycles of
Fish. Wiley, New York. 1974.
SIGNOR, A. A.; BOSCOLO,
W. R.; BITTENCOURT, F.; FEIDEN, A; GONÇALVES, G. S.; FREITAS, J. M. A. F.
Desempenho de juvenis de tilápia-do-nilo alimentados com rações contendo
complexo enzimático. Revista Brasileira
de Zootecnia, Viçosa, v. 39, n. 5, p.977-983, 2010.
SILVA, D.J.; QUEIROZ,
A.C. Análises de alimentos (métodos
químicos e biológicos). 3.ed. Viçosa, MG: Editora UFV, 2002. 235p.
SIMÕES, M. R.; RIBEIRO,
C. F. A.; RIBEIRO S. C. A.; PARK K. J.; MURR, F. E. X. Composição
físico-química, microbiológica e rendimento do filé de tilápia tailandesa (Oreochromis niloticus). Ciência e Tecnologia de Alimentos,
Campinas, v. 27 n. 3. p. 608-613, 2007.
WEATHERLEY, A. H.; GILL,
H. S. Protein, lipid, water and
caloric contents of immature rainbow trout, Salmo
gairdneri Richardson, growing at different rates. Journal of Fish Biology, v. 23, p. 653-673, 1983.
WEATHERLEY, A. H.; GILL, H. S. The biology of fish growth. London:
Academic, 1987. 443 p.
ZIMMERMANN, S. O bom desempenho das
Chitraladas no Brasil. Panorama da
Aqüicultura, Rio de Janeiro, v. 10, n. 60, p. 15-19, jul./ago. 2000.
ZIMMERMANN, S. Um moderno instrumental genético no melhoramento e na rastreabilidade de tilápias nilóticas. Panorama da Aqüicultura, Rio de Janeiro, v. 13, n. 76, p. 69, mar./abr. 2003. p. 69.
Protocolado em: 11 maio 2009. Aceito em 05 out. 2012.