Resumo
Considerando-se a necessidade de técnicas anestésicas respaldadas pela morfologia espécie-específica, objetivou-se descrever a morfometria do forame infraorbital de Raposa-do-campo a fim de correlacionar sua topografia com pontos de referência anatômica no crânio, oferecendo subsídio para um bloqueio anestésico local mais efetivo nesta espécie. Foram utilizados quatro crânios de Lycalopex vetulus, a partir dos quais foram realizadas todas as mensurações em cada antímero. O forame infraorbital localizou-se no osso maxila, dorsalmente ao terceiro dente pré-molar superior e, a partir do extremo caudal de sua margem ventral, distanciou-se, em média, 4,19 mm da margem alveolar desse osso; 14,10 mm da margem orbital ao nível do forame lacrimal; 37,10 mm do extremo dorsal do processo frontal do osso zigomático; 38,54 mm do extremo rostral da margem alveolar do dente incisivo medial superior; e 100,53 mm do extremo caudal da crista nucal ao nível do plano sagital mediano; além de apresentar um eixo sagital com uma média de 5,21 mm. Para a Raposa-do-campo sugere-se que a agulha seja introduzida por 4,19 mm em contato com o osso maxila, de forma perpendicular e em sentido ventrodorsal a partir de sua margem alveolar, utilizando como referência o diastema existente entre o terceiro e quarto dentes pré-molares superiores.
Palavras-chave: anestesiologia; morfologia aplicada; odontologia veterinária
Abstract
Whilst considering the need anesthetic techniques supported by species-specific morphology, it has been sought to describe the morphometry of the Hoary Fox's infraorbital foramen with aims at correlating its topography with points of anatomic reference in the skull, thereby providing subsidy for a more effective local anesthetic block in that species. Four skulls of Lycalopex vetulus had been used, from which all of the measurements in each antimere were performed. The infraorbital foramen was located at the maxilla bone, dorsally-wise from the third upper pre-molar tooth, and, from the ventral end of its caudal margin, it would stand apart from the alveolar margin of that bone by 4.19 mm, in average; from the orbital margin at the level of the lacrimal foramen by 14.10 mm; from the dorsal end of the frontal process of the zygomatic bone by 37.10 mm; from the rostral end of the alveolar margin of the first upper incisor tooth by 38.54 mm; and, from the caudal end of the nuchal crest by 100.53mm - at the level of the median sagittal plane; as it also presented a sagittal axis of 5.21 mm in average. It is suggested that, for the Hoary Fox, the needle be introduced by 4.19 mm in contact with the maxilla bone, in a perpendicular fashion, and in a ventral-dorsal orientation from the alveolar margin of the same - whilst using, as an anatomic reference, the diastema that exists between the third and the fourth upper pre-molar teeth.
Keywords: anesthesiology; applied morphology; veterinary dentistry
Seção: Medicina Veterinária
Recebido
22 de agosto de 2019.
Aceito
28 de janeiro de 2020.
Publicado
13 de março de 2020.
www.revistas.ufg.br/vet
Como citar - disponível no site, na página do artigo.
Introdução
A cavidade oral, os tecidos associados e os dentes, são estruturas essenciais para a sanidade dos animais domésticos e silvestres(1). No tocante à região em questão, é sabido que o bem-estar da referida região é fundamental para um eficiente processamento dos alimentos, relacionando-se diretamente com a manutenção de um bom estado nutricional e aumentos da capacidade reprodutiva, da expectativa e da qualidade de vida. Ainda neste contexto, a presença de doenças orais pode afetar de forma negativa e sistêmica a saúde animal(2), impactando de forma variável nas populações silvestres por serem, possivelmente, limitantes da expectativa de vida(3).
Diante do exposto, a odontologia veterinária configura-se como uma das especialidades com maior potencial em contribuir significativamente para o bem-estar dos animais, notadamente daqueles mantidos em cativeiro(1). Nos zoológicos, como exemplo, o mapeamento, atendimento e tratamento odontológicos vêm sendo destaque nas últimas décadas por permitir que diagnósticos sejam realizados de forma precoce, o que pode diminuir a morbidade e mortalidade inerentes a estas situações(4).
Tais procedimentos clínicos, ainda que pareçam complexos, na maioria das vezes são de fácil execução, entretanto, requerem o conhecimento da anatomia topográfica e das variadas possibilidades terapêuticas aplicadas à região a ser manipulada(5). O bloqueio neural regional é a estratégia anestésica mais comumente empregada na rotina odontológica animal(6) e, assim sendo, demanda de um constante processo de desenvolvimento e aperfeiçoamento para pacientes silvestres, uma vez que, grande parte das técnicas utilizadas foi elaborada para espécimes domésticos. Logo, tornam-se essenciais estudos que demonstrem metodologias respaldadas pela morfologia espécie-específica(7).
Portanto, objetivou-se descrever a morfometria do forame infraorbital de Raposa-do-campo a fim de correlacionar sua topografia com pontos de referência anatômica no crânio, oferecendo subsídio para um bloqueio anestésico local mais efetivo nesta espécie.
Material e métodos
Foram utilizados quatro crânios de cadáveres adultos de Lycalopex vetulus, sendo dois machos e duas fêmeas, constituintes do acervo de pesquisa do Laboratório de Anatomia da Faculdade de Ciências Biológicas da Universidade Federal de Goiás, Regional Catalão (UFG) (Brasil). O preparo do material foi iniciado pela retirada da pele e tecidos moles da região da cabeça, com consecutiva desarticulação temporomandibular. Após, prosseguiu-se com o processo de maceração química com hidróxido de sódio (NaOH, concentração 98% - 99%, Lavitex®, Patos de Minas, MG, Brasil) durante 30 minutos para sua limpeza, e posterior clareamento por imersão em solução aquosa de peróxido de hidrogênio (H2O2, concentração 30% - 36%, Dinâmica®, Indaiatuba, SP, Brasil) com diluição 1:10, também durante 30 minutos.
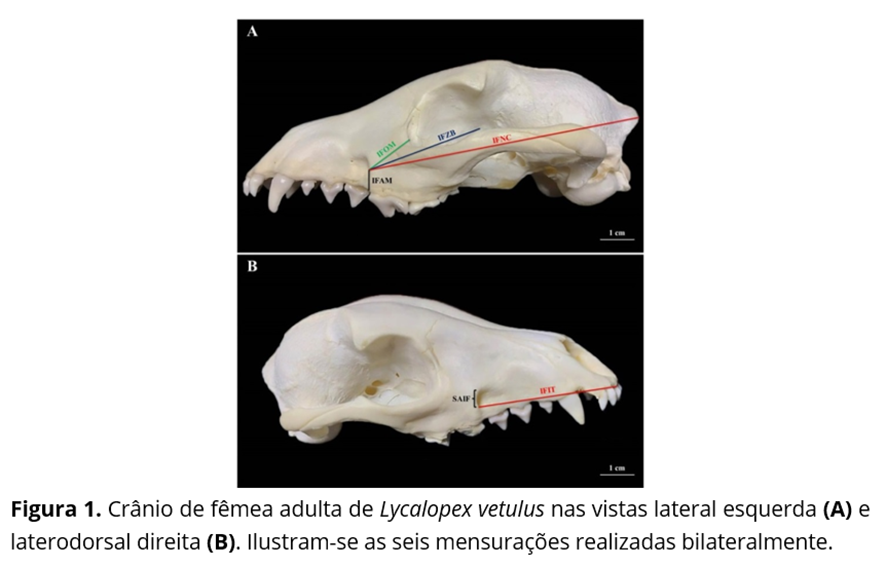
Em sequência, baseando-se nas pesquisas de Igado(8), Moraes(7) e Maximiano Neto(9), um examinador único, e em duplicata, procedeu com as biometrias propostas em cada um dos oito antímeros utilizando um paquímetro eletrônico digital Starrett® (capacidade 0 – 150 mm, resolução 0,01 mm e exatidão ± 0,02 mm, Itu, SP, Brasil); sendo elas (Fig. 1): SAIF: comprimento do eixo sagital do forame infraorbital; IFAM: distância entre o extremo ventral da margem caudal do forame infraorbital e a margem alveolar do osso maxila nesse nível; IFOM: distância entre o extremo ventral da margem caudal do forame infraorbital e a margem orbital ao nível do forame lacrimal; IFZB: distância entre o extremo ventral da margem caudal do forame infraorbital e o extremo dorsal do processo frontal do osso zigomático; IFIT: distância entre o extremo ventral da margem caudal do forame infraorbital e o extremo rostral da margem alveolar do dente incisivo medial superior; IFNC: distância entre o extremo ventral da margem caudal do forame infraorbital e o extremo caudal da crista nucal ao nível do plano sagital mediano.
Os dados numéricos obtidos foram submetidos à análise estatística descritiva (média aritmética, desvio padrão e coeficiente de variação) e ao teste-t de student com confiabilidade de 95%, via software BioEstat® 5.3. A nomenclatura anatômica utilizada para descrição esteve de acordo com o International Committee on Veterinary Gross Anatomical Nomenclature(10), e o estudo foi aprovado pelo Comitê de Ética na Utilização de Animais da Universidade Federal de Uberlândia (Brasil), protocolo n° 81/14.
Resultados
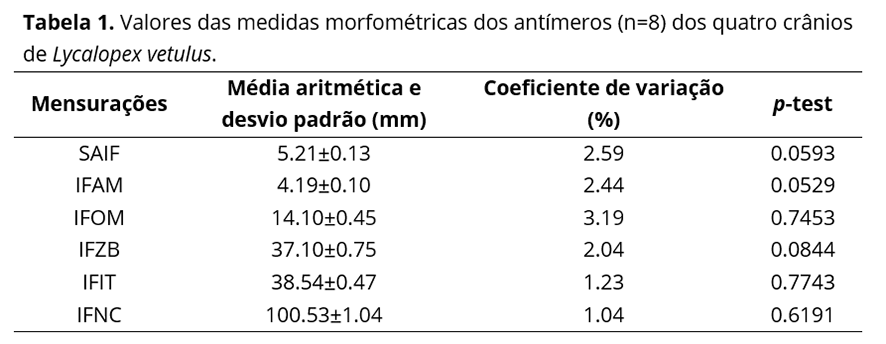
Na totalidade dos crânios analisados, o forame infraorbital localizou-se no osso maxila, dorsalmente ao terceiro dente pré-molar superior e, a partir do extremo ventral de sua margem caudal, distanciou-se, em média, 4.19±0.10 mm da margem alveolar desse osso (IFAM); 14.10±0.45 mm da margem orbital ao nível do forame lacrimal (IFOM); 37.10±0.75 mm do extremo dorsal do processo frontal do osso zigomático (IFZB); 38.54±0.47 mm do extremo rostral da margem alveolar do dente incisivo medial superior (IFIT); e 100.53±1.04 mm do extremo caudal da crista nucal ao nível do plano sagital mediano (IFNC); além de apresentar um eixo sagital com uma média de 5.21±0.13 mm (SAIF).
Nenhuma diferença estatisticamente significante foi observada quando os valores obtidos a partir das mensurações realizadas em ambos os antímeros foram confrontados, conforme demonstrado na Tabela 1.
Com base nas análises, sugere-se que o bloqueio anestésico local do nervo infraorbital possa ser obtido com a penetração da agulha por 4.19 mm em contato com o osso maxila, de forma perpendicular e em sentido ventrodorsal a partir de sua margem alveolar, utilizando como referência anatômica o diastema existente entre o terceiro e quarto dentes pré-molares superiores (Fig. 2).

Discussão
Ao longo das últimas décadas, o controle da dor vem sendo um importante tópico de estudo, tanto para a medicina humana quanto para a veterinária e, nesse cenário, cada vez mais, a anestesia local tem sido utilizada de forma adjunta às técnicas de anestesia geral em procedimentos odontológicos(11). Entretanto, para que a administração dos fármacos seja mais efetiva e reduzam-se os riscos de complicações decorrentes, o conhecimento anatômico da inervação da cavidade oral e estruturas adjacentes é de caráter fundamental(12).
Responsável pela inervação dos dentes(13-16) e lábio superiores, mucosa nasal, pele do nariz externo(14-17) e vibrissas locais(15), o nervo infraorbital representa a ramificação final do nervo maxilar, logo que esse penetra no canal infraorbital através do forame maxilar, ainda no interior da fossa pterigopalatina; e termina por se ramificar superficialmente na região lateral da face após emergir pelo forame infraorbital(13-16).
Na Raposa-do-campo, assim como observado por Dyce et al.(18) em animais domésticos, Getty(15), Lantz(17), Lopes e Gioso(11), König e Liebich(16) e Evans e de Lahunta(14) em cães domésticos, e Maximiano Neto(9) em 36.36% dos espécimes de Cachorro-do-mato (Cerdocyon thous); o forame infraorbital localizou-se no osso maxila, dorsalmente ao terceiro dente pré-molar superior. Já nos cães locais da Nigéria, Igado(8) destaca que, ainda que esse acidente ósseo tenha se posicionado na região anatômica supracitada, seu limite ventral inclinou-se caudalmente até o espaço existente entre o terceiro e quarto dentes pré-molares superiores, enquanto que, segundo Moraes(7), no Lobo-guará (Chrysocyon brachyurus), este foi essencialmente dorsal a estes mesmos dois dentes, tal qual reportado por Maximiano Neto(9) em 63.64% dos espécimes de Cachorro-do-mato.
De forma bastante ampla, este forame é facilmente palpável nos animais domésticos(18), podendo, reconhecidamente, ser utilizado como ponto de referência anatômica para a anestesia local do nervo infraorbital(16), responsável por dessensibilizar a polpa dos dentes incisivos, canino, e primeiro e segundo pré-molares superiores, osso e tecidos moles adjacentes, pálpebra inferior, lábio superior e a região lateral do nariz externo, ipsilateralmente. Infiltrações mais profundas ou com doses adicionais podem atingir até o quarto dente pré-molar superior(12).
Para a realização nos cães domésticos, é recomendado o posicionamento da agulha em sentido caudal a partir da mucosa alveolar próxima do forame até aproximadamente o limite ventral de sua abertura(12, 19), ou projetando-a até o interior do canal infraorbital para a obtenção de anestesias em regiões mais caudais, entretanto, por não mais do que 1 cm(17). No Lobo-guará, foi sugerida que a introdução fosse conduzida através do vestíbulo oral, de forma justaposta à face lateral da margem alveolar do osso maxila e em sentido vertical por aproximadamente 10 mm entre o terceiro e quarto dentes pré-molares superiores(7), entretanto, sem a discussão de possíveis vantagens com a alteração da técnica.
Semelhantemente a esta, na Raposa-do-campo indica-se que a penetração da agulha ocorra por 4.19 mm em contato com o osso maxila, de forma perpendicular e em sentido ventrodorsal a partir de sua margem alveolar, utilizando como referência anatômica o diastema existente entre o terceiro e quarto dentes pré-molares superiores. Desta forma, diferentemente da aplicação proposta para os cães domésticos, onde a agulha é projetada no sentido de emergência do nervo infraorbital, e tal qual sugerido por Magalhães et al.(20) no processo de aperfeiçoamento do bloqueio anestésico do nervo alveolar inferior nesta mesma espécie, acredita-se que a extremidade perfuro-cortante relacionar-se-á apenas com o extremo ventral da margem caudal do forame infraorbital, preservando a funcionalidade da região e evitando a ocorrência de lesões neurais decorrentes da técnica.
Dentre os benefícios aspirados com o seu aperfeiçoamento destacam-se as reduções da reação tissular inflamatória local, da quantidade de anestésicos gerais requeridos, da sensibilização central à dor e do emprego de fármacos no pós-operatório(6), evitando-se o aparecimento de hematomas, parestesias, traumas teciduais(11) e necrose focal(21).
Conclusões
Em conclusão, indica-se que para a realização do bloqueio anestésico local do nervo infraorbital de Raposa-do-campo a agulha seja introduzida por 4.19 mm em contato com o osso maxila, de forma perpendicular e em sentido ventrodorsal a partir de sua margem alveolar, utilizando como referência anatômica o diastema existente entre o terceiro e quarto dentes pré-molares superiores; evitando a ocorrência de lesões neurais decorrentes da técnica e preservando a funcionalidade da região, de importância já reconhecida para a manutenção da sanidade animal.
Agradecimentos
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo apoio financeiro aos autores.
Referências
1. Pachaly JR. Odontoestomatologia. In: Cubas ZS, Silva JCR, Catão-Dias JL. Tratado de animais selvagens. São Paulo: Roca; 2007. p. 1068-1091. Portuguese.
2. Pachaly JR, Gioso MA. The oral cavity. In: Fowler ME, Cubas ZS. Biology, medicine and surgery of South American wild animals. Ames: Iowa State University Press; 2001. p. 457-463. English.
3. Stimmelmayr R, Maier JAK, Persons K, Battig J. Incisor tooth breakage, enamel defects, and periodontitis in a declining Alaskan moose population. Alces. 2006;42:65-74.
4. Glatt SE, Francl KE, Scheels JL. A survey of current dental problems and treatments of zoo animals. International Zoo Yearbook. 2008;42(1):206-213. https://doi.org/10.1111/j.1748-1090.2007.00032.x
5. Moura AG, Bernardino Júnior R, Severino RS, Teixeira CS. Topografia dos forames mentonianos laterais em suínos das linhagens Agroceres e Seghers Genetics do Brasil. Bioscience Journal. 2006;22(2):119-123.
6. Holmstrom SE, Frost-Fitch P, Eisner ER. Veterinary dental techniques for the small animal practitioner. 3rd ed. Philadelphia: Saunders; 2004. 689p. English.
7. Moraes FM. Morfometria dos forames mandibular, mentual e infraorbital de lobo-guará Chrysocyon brachyurus, Illiger, 1815 aplicada a bloqueios anestésicos. Tese (Doutorado em Ciências Veterinárias), Universidade Federal de Uberlândia; 2016. 55f. https://repositorio.ufu.br/handle/123456789/17588
8. Igado OO. Rostrofacial Indices of the Nigerian Local Dog: Implications in Veterinary Oral and Maxillo-facial Anaesthesiology of the Dolichocephalic Canine Breed. International Journal of Morphology. 2014;32(2):738-743. https://doi.org/10.4067/S0717-95022014000200059
9. Maximiano Neto A. Morfometria do crânio de cachorro-do-mato Cerdocyon thous. Tese (Doutorado em Ciências Veterinárias), Universidade Federal de Uberlândia; 2017. 58f. https://repositorio.ufu.br/handle/123456789/20856
10. International Committee on Veterinary Gross Anatomical Nomenclature. Nomina Anatomica Veterinaria. 6th ed. Hannover, Ghent, Columbia, MO, Rio de Janeiro: Editorial Committee; 2017. 178p. English.
11. Lopes FM, Gioso MA. Anestesia local aplicada à odontologia veterinária. Medvep. 2007;5(14):32-39.
12. Beckman B, Legendre L. Regional nerve blocks for oral surgery in companion animals. Compendium on Continuing Education for the Practising Veterinarian –North American Edition. 2002;24(6):439-444.
13. Budras KD, Mccarthy PH, Fricke W, Richter R, Horowitz A, Berg R. Anatomia do cão: texto e atlas. 5th ed. Barueri: Manole; 2012. 219p. Portuguese.
14. Evans HE, de Lahunta A. Guide to the dissecation of the dog. 8th ed. Saint Louis: Elsevier; 2017. 344p. English.
15. Getty R. Anatomia dos Animais Domésticos. 5th ed. Rio de Janeiro: Guanabara Koogan; 1986. 2000p. Portuguese.
16. König HE, Liebich HG. Anatomia dos Animais Domésticos: texto e atlas colorido. 6th ed. Porto Alegre: Artmed; 2016. 804p. Portuguese.
17. Lantz GC. Regional anesthesia for dentistry and oral surgery. Journal of Veterinary Dentistry. 2003;20(3):181-186. https://doi.org/10.1177/089875640302000306
18. Dyce KM, Sack WO, Wensing CJG. Textbook of Veterinary Anatomy. 4th ed. Saint Louis: Elsevier; 2010. 834p. English.
19. Love L, Egger C. Local and regional anesthesia techniques, Part 3: Blocking the maxillary and mandibular nerves. Vet Med. 2009;104(6):12-15.
20. Magalhães HIR, Romão FB, de Paula YH, Luz MM, Barcelos JB, Silva Z, Carvalho-Barros RA, Ribeiro LA. Morphometry of the mandibular foramen applied to local anesthesia in hoary fox (Lycalopex vetulus). Pesquisa Veterinária Brasileira. 2019;39(4):278-285. https://doi.org/10.1590/1678-5150-PVB-5749
21. McLure HA, Rubin AP. Review of local anaesthetic agents. Minerva Anestesiologica. 2005;71(3):59-74.