DOI: 10.1590/1089-6891v20e-48586
ZOOTECNIA
SUPLEMENTAÇÃO DE SELÊNIO NA DIETA E QUALIDADE ESPERMÁTICA DO SÊMEN DE TOUROS BRANGUS
DIETARY SELENIUM SUPPLEMENTATION AND SPERM QUALITY IN BRANGUS BULLS SEMEN
Pedro Paulo Tsuneda1* ORCID - http://orcid.org/0000-0001-8508-7931
Bruno Hiroshi Tsuneda¹ ORCID - http://orcid.org/0000-0002-7957-2452
Luciana Keiko Hatamoto-Zervoudakis¹ ORCID - http://orcid.org/0000-0001-6030-096X
Joanis Tilemahos Zervoudakis¹ ORCID - http://orcid.org/0000-0002-1864-3237
Walter Augusto dos Santos Marinho³ ORCID -http://orcid.org/0000-0003-1626-8629
Moacir Ferreira Duarte Júnior¹ ORCID - http://orcid.org/0000-0001-7383-1102
Eleonora Barbosa Araújo² ORCID - http://orcid.org/0000-0002-3813-5272
Tathiana Ferguson Motheo¹ ORCID - http://orcid.org/0000-0002-2202-0331
Luis Eduardo Senra e Silva¹ ORCID - http://orcid.org/0000-0002-5703-0249
1Universidade Federal do Mato Grosso, Cuiabá, MT, Brasil.
2EMBRAPA Recursos Genéticos e Biotecnologia, Brasília, DF, Brasil.
3 Universidade Federal do Mato Grosso, Cuiabá, MT, Brasil; Instituto Federal de Ciência e Tecnologia de Mato Grosso, São Vicente, MT, Brasil.
*Autor para correspondência – pedrotsuneda@hotmail.com
Resumo
Objetivou-se avaliar a qualidade espermática do sêmen de touros suplementados com selênio (Se) na dieta. Foram utilizados 16 touros Brangus, igualmente distribuídos em grupo controle (GC) e grupo Se (GSe − 0,1mg de Se/kg de MS de dieta). O experimento teve duração de 75 dias, e os animais foram suplementados por 60 dias. Foram realizadas quatro coletas de sêmen durante o período (0, 30, 60 e 75 dias) por animal. As amostras foram avaliadas quanto a motilidade e vigor espermáticos, integridade e funcionalidade da membrana plasmática (teste de expansão hiposmótico – HIPO) e viabilidade espermática e reação acrossomal (coloração tripla ̶ TRI). Após avaliação, estas foram diluídas em meio Tris-gema com 5% de glicerol, envasadas (40x106 espermatozoides/palheta), resfriadas, congeladas e armazenadas em nitrogênio líquido até a análise. Após descongelação, foram submetidas às mesmas avaliações descritas para o sêmen fresco. Não houve interferência da suplementação com Se nas variáveis vigor espermático, HIPO e TRI do sêmen fresco e descongelado. Porém, constatou-se queda na motilidade espermática do GSe comparativamente ao GC no sêmen fresco (P=0,0035) e descongelado (P=0,0067) após 60 dias de suplementação. Portanto, a suplementação de Se na dieta não foi efetiva na promoção de melhorias dos parâmetros espermáticos de touros Brangus.
Palavras-chave: antioxidantes, criopreservação, espermatozoide.
Abstract
The aim of the present study was to evaluate sperm quality of bulls supplemented with selenium (Se) in the diet. Sixteen Brangus bulls were randomly divided in two groups: control (GC) and Se (GSe - 0.1mg Se/kg dietary DM). The experiment lasted 75 days and the animals were supplemented for 60 days. Four semen collections (0, 30, 60 and 75 days) per animal, were performed during the experimental period. Sperm motility and vigor, plasma membrane integrity and functionality (hyposmotic swelling test - HOST) and sperm viability and acrosome reaction (triple staining -TRI) were assessed. After immediate analysis, samples were diluted in Tris-egg yolk extender with 5% glycerol, packed (40x106 spermatozoa / straw), chilled, frozen and stored in liquid nitrogen until analysis. After thawing, sperm motility and vigor, HOST and TRI were performed. No significance was noticed on sperm vigor, HOST and TRI of fresh and post-thawed semen after dietary selenium supplementation. However, sperm motility decreased in GSe compared to GC in fresh (P = 0.0035) and post- thawed (P = 0.0067) semen samples after 60 days of supplementation. Therefore, dietary selenium supplementation was ineffective to improve semen parameters of fresh and post-thawed semen of Brangus bulls.
Keywords: antioxidant, cryopreservation, spermatozoa.
Recebido em 07 de agosto de 2017.
Aceito em 18 de setembro de 2018.
Introdução
Dentre as biotecnologias reprodutivas, o processo de criopreservação apresenta contribuição importante no aumento da produção bovina em rebanhos comerciais e de animais de alto valor zootécnico(1). Entretanto, a criopreservação de sêmen é um processo que promove grande estresse celular e impõe aos espermatozoides condições extremamente desfavoráveis à manutenção de sua viabilidade(2).
Durante o processo de congelação seminal, a peroxidação lipídica associada ao estresse oxidativo tem sido relacionada à ocorrência de efeitos deletérios na função reprodutiva do macho(3).
A membrana plasmática do espermatozoide é formada por uma bicamada lipídica, que é extremamente vulnerável à ação de espécies reativas ao oxigênio (EROS)(4). Além disso, em bovinos, as EROS podem ser geradas por espermatozoides mortos como resultado de uma reação catalisada oxidativa de aminoácidos(5).
No sêmen, a produção e a degradação das espécies reativas ao oxigênio são consideradas fisiológicas, sendo cruciais em mecanismos responsáveis pela fertilidade espermática. Em contrapartida, o processo de criopreservação aumenta a produção de EROS, a qual resulta em desequilíbrio entre a sua produção e a eliminação pelo sistema antioxidante intra e extracelular(6).
A maioria dos organismos vivos desenvolve complexos sistemas antioxidantes para proteção e reparação de suas células. Estes, por sua vez, atuam por meio da ação de enzimas ou micromoléculas(7) e são capazes de prevenir a formação de EROS, inativar e/ou remover produtos do processo de lipoperoxidação(8) e promover o reparo de lesões promovidas pelas EROS(9).
Dentre os agentes antioxidantes, destacam-se alguns nutrientes “sequestradores” enzimáticos e algumas enzimas, como a glutationa peroxidase (GPx). Esta, por sua vez, é uma enzima citoplasmática antioxidante abundante no meio intracelular e é frequentemente oxidada em dissulfeto de glutationa(10). O selênio é um elemento essencial para várias funções do organismo, como crescimento, resposta imunológica e manutenção da integridade celular e tecidual. Este atua como cofator da glutationa peroxidase, que protege a célula contra o estresse oxidativo(11).
Sendo assim, dada a importância dos danos oxidativos provocados pelo processo de congelação sobre a qualidade espermática de reprodutores bovinos e dos possíveis efeitos benéficos da suplementação com selênio, o objetivo do presente estudo foi avaliar a influência da suplementação da dieta com selênio sobre a qualidade espermática do sêmen de touros Brangus.
Material e métodos
Todos os procedimentos aqui descritos foram revisados e aprovados pelo Comitê de Ética e Bem-Estar Animal da Universidade Federal do Mato Grosso (número do protocolo: 23108.060964 / 13-6).
O experimento foi realizado na Fazenda Sereno ̶ GAP, localizada no município de Jaciara (Latitude 15.9561, Longitude 549632 15°, 57’22’’Sul, 54° 57’48’’Oeste), no período da seca (junho a setembro).
Foram utilizados 16 touros da raça Brangus (5/8 Angus 3/8 Zebu), com idade média de dois anos e peso vivo médio inicial de 472 kg. Previamente ao início do experimento, os animais foram submetidos ao controle de endoparasitas (Doramectina 1%, Dectomax® Zoetis, Brasil) e ectoparasitas (Cipermetrina e Ethion, Ciperthion®, Intervet Schering-Plough, Brasil).
A área experimental destinada aos animais foi constituída por dois piquetes de 7,35/ha cada, com Panicum maximum cv. Mombaça, os quais foram providos de bebedouro e cocho com dimensões que permitiam o acesso de todos os animais simultaneamente.
Os animais foram mantidos em pastejo contínuo, recebendo diariamente suplementação concentrada (Tabela 1).
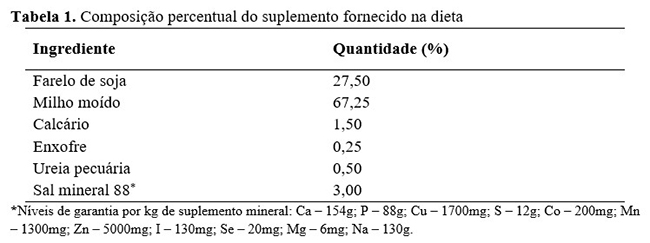
Os suplementos foram formulados de forma a apresentarem 21% de PB na matéria natural. Estes eram fornecidos em quantidade equivalentes a 4,5 kg/animal/dia, sempre às 11:00, a fim de minimizar as interferências no comportamento de pastejo.
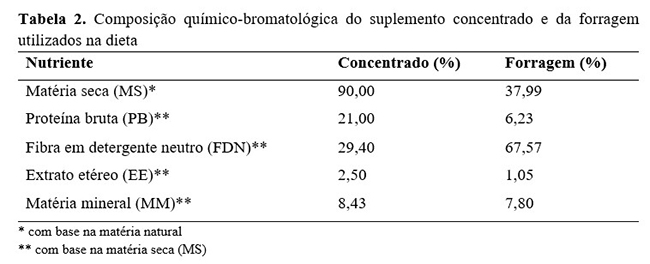
Considerando-se a categoria animal e peso vivo médio dos animais, estimou-se o consumo de matéria seca (CMS) em 11,55kg de MS/dia(12). Foram coletadas amostras de pasto e do suplemento para posterior análise no Laboratório de Nutrição Animal da Faculdade de Agronomia e Zootecnia da Universidade Federal de Mato Grosso (FAAZ − UFMT). Dessa forma, realizou-se pré-secagem das amostras em estufa ventilada por 72 horas e, ato contínuo, estas foram processadas em moinho com peneira de malha de 1,0 mm e acondicionadas em potes de plástico. Foram determinados os teores de matéria seca (MS), proteína bruta (PB), fibra em detergente neutro (FDN), extrato etéreo (EE) e matéria mineral (MM). Exceto pela análise de FDN(13), as demais análises seguiram as recomendações de Silva e Queiroz(14) (Tabela 2).
Antes do início do experimento, os animais passaram por um período de adaptação aos piquetes e ao concentrado de 10 dias. Este teve duração de 75 dias, sendo os animais suplementados por 60 dias. Ao final da suplementação, os animais continuaram recebendo o mesmo manejo, sendo fornecido concentrado sem a suplementação de selênio por mais 15 dias para a avaliação de possível efeito residual.
Os animais foram divididos aleatoriamente em dois lotes, os quais foram distribuídos em dois tratamentos: grupo controle (GC, suplemento concentrado) e grupo selênio (GSe, suplemento concentrado com adição de 0,1mg de Se/kg de matéria seca na dieta(15)).
Durante o período experimental, foram realizadas quatro coletas de sêmen, sendo estas realizadas nos dias 0, 30, 60 e 75 (COL 1, COL 2, COL 3 e COL 4, respectivamente). Adotou-se para dia 0 (D0) o dia anterior ao início da suplementação.
Após contenção, os animais foram submetidos a exames clínicos gerais e específicos. Em seguida, o sêmen foi coletado por meio de eletroejaculação, sendo utilizado o aparelho Eletrovet® (Eletro Veterinária Ltda, Valinhos, SP, Brasil). O sêmen foi recolhido em tubo plástico graduado aquecido e protegido da luz. Ato contínuo, foram realizadas análises subjetivas de motilidade (0 -100%, onde 0%: nenhum espermatozoide móvel e 100%: todos os espermatozoides móveis) e vigor espermáticos (0-5, onde 0: ausência de movimento e 5: movimentos vigorosos e progressivos) sob microscopia óptica em aumento de 400x(16). Dessa forma, uma alíquota de sêmen foi diluída em formol salino na proporção de 1:200 para análise de concentração espermática em câmara de Neubauer16. Ainda, foram avaliadas a integridade e a funcionalidade da membrana plasmática pelo teste de expansão hiposmótico (HIPO)(17) e a integridade da membrana acrossomal e reação acrossomal pela coloração tripla (TRI)(18).
Para a realização do teste de expansão hiposmótico, homogeneizaram-se 100 µL de amostra a 900 µL de solução hiposmótica (150 mOsml). Como controle, o mesmo processo foi realizado, utilizando-se uma solução isosmótica (300 mOsml). As amostras foram então mantidas em banho-maria a 37 °C, durante 30 minutos. Transcorrido esse período, uma gota de cada amostra foi colocada entre lâmina e lamínula para a contagem de 200 células, em microscópio de contraste de fase sob aumento de 400x. Os espermatozoides foram classificados quanto a presença (membrana íntegra e funcional) ou não (membrana não íntegra ou afuncional) de cauda enrolada. O resultado foi expresso em porcentagem de células com membrana íntegra e obtido pela diferença entre a porcentagem de células espermáticas com cauda enrolada resultantes do teste hiposmótico da porcentagem de espermatozoides com cauda enrolada patológica (resultantes da solução isosmótica)(17).
A integridade da membrana acrossomal e a reação acrossômica foi avaliada por meio da coloração tripla (TRI). Sendo assim, 300 μL de suspensão espermática foram diluídos em igual volume de solução de 0,85% de NaCl, contendo 2% de corante “trypan blue”. Em seguida, a mistura foi incubada a 37 °C por 15 minutos e, após esse período, foi lavada em tampão fosfato salino (PBS) por meio de centrifugação a 400G por 5 minutos. O processo foi continuamente repetido até que o sobrenadante ficasse límpido. Após o descarte do sobrenadante da última lavagem, o pellet formado foi homogeneizado com 50 μL de solução de glutaraldeído a 3% e posteriormente incubado a 36 °C em banho-maria por 20 minutos. Transcorrido esse período, foi acrescentado o mesmo volume de PBS, e a amostra foi novamente centrifugada a 400G por 5 minutos. O excesso de sobrenadante foi descartado e foram confeccionados esfregaços com o material remanescente. Após secagem, as lâminas foram coradas em solução de Bismarck Brown (0,8%) a 40 °C por 5 minutos e, em seguida, coradas em solução de Rosa Bengala (0,8%) em temperatura ambiente por 20 minutos. O excesso de corante foi lavado em água corrente e as lâminas secas a temperatura ambiente.
Para mensurar a viabilidade e o estado do acrossoma, foram avaliadas 200 células, sob microscopia de contraste de fase em aumento de 1250X. De acordo com a técnica, foram observados quatro padrões de coloração: TRI I ̶ espermatozoides vivo e intactos: corados de castanho na região pós-acrossomal e de rosa no acrossomo; TRI II − espermatozoides vivos com reação acrossômica: corados de castanho na região pós-acrossomal e de branco no acrossomo; TRI III ̶ espermatozoides mortos com acrossomo intacto: corados de azul na região pós-acrossomal e de rosa no acrossomo, e TRI IV − espermatozoides mortos com reação acrossômica degenerativa: corados de azul na região pós-acrossomal e de branco no acrossomo(18).
Após avaliação imediata, cada ejaculado foi diluído em extensor tris-gema (3,187g TRIS-hidroximetil amino metano; 1,78g ácido cítrico monohidratado; 1,316g frutose; 80 mL água destilada; 20 mL gema de ovo; 100 mg de estreptomicina; 100000UI de penicilina; 5 mL de glicerol para cada 100 mL de diluidor)(19) em fração única para obtenção de concentração de 40x106 espermatozoides/palheta. Cinco palhetas de sêmen de cada animal por coleta foram submetidas ao processo de criopreservação de acordo com a metodologia descrita por Beconi et al.(20). Dessa forma, o sêmen foi envasado em palhetas de 0,5 mL, as quais foram submetidas a 4 horas de resfriamento (4 °C). Ato contínuo, estas foram colocadas em contato com o vapor de nitrogênio (a 5 cm do nitrogênio líquido, -120 °C) por 15 minutos e em seguida submergidas em nitrogênio líquido. Por fim, as amostras foram armazenadas em botijão criogênico (-196 ºC) até análise.
A descongelação foi realizada segundo a metodologia proposta por Beconi et al.(20). Sendo assim, as amostras foram descongeladas a 37 °C durante 30 segundos e 10 µL foram utilizados para análise de motilidade e vigor espermáticos. Ainda, foram retiradas alíquotas de sêmen para realização do teste de expansão hiposmótico e para coloração tripla.
O experimento foi realizado em delineamento inteiramente casualizado com medidas repetidas no tempo. Os dados foram analisados através de análise de variância (ANOVA) com um nível de significância de 5% com auxílio do programa estatístico SAS (Cary, Carolina do Norte, EUA)(21).
Resultados e discussão
Em nosso estudo, foram utilizados 16 touros em repouso sexual, fato este que pode explicar a baixa qualidade do sêmen a fresco observada na primeira coleta (Tabela 3) e nos valores obtidos nas demais coletas e pós-criopreservação (Tabela 4).
Ainda, ao longo do período experimental, não foi observada interferência da suplementação com selênio na dieta nos valores de vigor espermático, integridade e funcionalidade da membrana plasmática (HIPO) e integridade da membrana acrossomal e reação acrossomal (TRI) do sêmen fresco e descongelado. Em contrapartida, ao avaliar a motilidade espermática, foi constatado aumento gradativo nos valores dessa variável tanto no grupo controle como no grupo suplementado com selênio. Porém, após 60 dias de suplementação, o grupo suplementado apresentou queda nos valores de motilidade comparativamente ao grupo controle (P=0,0035) e, após o fim da suplementação com selênio na dieta, a porcentagem de espermatozoides móveis voltou a aumentar (Tabela 3). Comportamento semelhante foi constatado em amostras criopreservadas obtidas da terceira coleta (P=0,0067) (Tabela 4), na qual a motilidade espermática observada no grupo suplementado com selênio foi inferior ao grupo não suplementado.
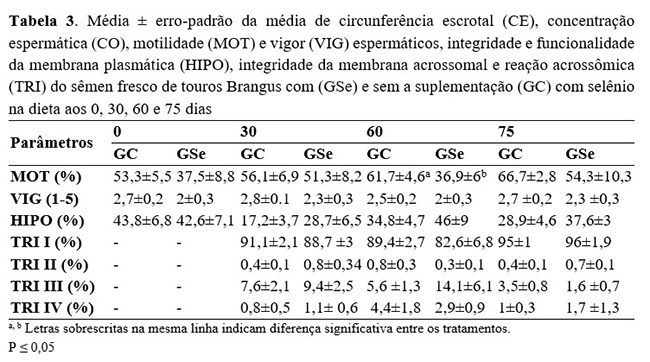
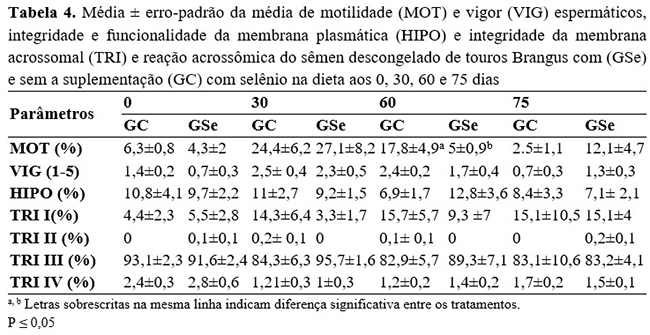
Inúmeros estudos associam a suplementação com selênio à performance reprodutiva de machos e a melhorias na concentração, motilidade e morfologia espermáticas(22 - 26) . Tais benefícios estão associados principalmente a sua ação como cofator da enzima glutationa peroxidase que, por sua vez, atua neutralizando a ação das EROS sobre o espermatozoide(10 - 11, 20, 22-23). Porém, no presente estudo, apesar da utilização de concentrações de selênio recomendadas para essa categoria animal, sua utilização contínua na dieta foi deletéria para a motilidade espermática, sugerindo possível efeito acumulativo e tóxico desse mineral, uma vez que, após sua remoção, constatou-se aumento dessa variável.
A ação de qualquer antioxidante sobre a fertilidade do sêmen respeita uma regressão polinomial, ou seja, à medida que se adiciona a substância com propriedade de neutralizar os agentes oxidantes, espera-se que a variável relacionada à fertilidade dos espermatozoides aumente, principalmente se o sistema já estiver em desequilíbrio. Contudo, aos poucos a adição de antioxidantes passa a deprimir a fertilidade, isso porque sabe-se que as espécies reativas de oxigênio participam de diversas reações da célula espermática, sendo que várias delas afetam os padrões de movimento(27). Desse modo, o uso prolongado do selênio na dieta pode ter afetado negativamente a motilidade do sêmen fresco e, consequentemente, do sêmen criopreservado.
Embora seja pouco descrito, o selênio proveniente da dieta pode levar a quadros de intoxicação. Compostos derivados do selênio como selenito, disselenito e dióxido de selênio podem reagir com tióis e produzir superóxido e outras espécies reativas de oxigênio capazes de causar danos aos espermatozoides(28). Ainda, apesar de alguns autores relatarem deficiência de selênio nas pastagens(23), acredita-se que a dosagem desse elemento é essencial para que não ocorra uma suplementação excessiva desse mineral de animais mantidos a pasto. Dessa forma, apesar da ausência de sinais clínicos de toxicidade, o decréscimo da motilidade espermática constatado em nosso estudo pode ter sido decorrente de excesso de selênio na dieta, uma vez que os animais eram mantidos a pasto e a suplementação foi feita com base no NRC(12) específico para essa categoria animal.
Trabalhos que relacionem o efeito da suplementação com selênio com os parâmetros qualitativos e quantitativos do sêmen de bovinos são raros. Sendo assim, mais estudos na área, variando os níveis e a fonte do selênio, se fazem necessários para elucidar o efeito desse mineral na atividade reprodutiva desses animais.
Conclusão
Com base nos resultados encontrados, conclui-se que a suplementação com selênio na concentração de 0,1 mg/kg de MS na dieta não foi efetiva na promoção de melhorias na qualidade espermática do sêmen fresco e criopreservado de touros da raça Brangus.
Referências
1. Leite PA, Schreder GG, Almeida CLR, Zúccari CESN, Costa e Silva EV. Criopreservação do sêmen bovino. Cientifica Ciências Biologia e Saúde. 2011; 13(4):279-86.
2. Purdy PH. A review on goat sperm cryopreservation. Small Rum Res. 2006; 63:215-225. Doi: http://dx.doi.org/10.1016/j.smallrumres.2005.02.015
3. Aitken RJ, Jones KT, Robertson SA. Reactive oxigens species and sperm function – in sickness and in health. J Androl. 2012; 33:1096-1106. Doi: http://dx.doi.org/10.2164/jandrol.112.016535.
4. Brouwers JFHM, Gadella BM. In situ detection and localization of lipid peroxidation in individual bovine sperm cells. Free Rad Biol Med. 2003; 35:1382-1391. Doi: http://dx.doi.org/10.1016/j.freeradbiomed.2003.08.010
5. Sariözkan S, Bucak MN, Tuncer PB, Ulutas PA, Bilgen A. The influence of cysteine and taurine onmicroscopic-oxidative stress parameters and fertilizing ability of bull semen following cryopreservation. Cryobiology. 2009; 58:134-138.Doi: http://dx.doi.org/10.1016/j.cryobiol.2008.11.006
6. Maia MS, Bicudo SD. Radicais livres, antioxidantes e função espermática em mamíferos: uma revisão. Rev Bra Reprod Anim. 2009; 33(4):183-193.
7. Barreiros ALBS, David JM, David JP. Estresse oxidativo: relação entre geração de espécies reativas e defesa do organismo. Quím Nova. 2006; 29(1):113-123. Doi: http://dx.doi.org/10.1590/S0100-40422006000100021
8. Huang Z, Roze AH, Hoffmann PR. The role of selenium inflammation and immunity: from molecular mechanisms to therapeutic opportunities. Antiox Redox Signal. 2012; 16(7):705-743. Doi: http://dx.doi.org/10.1089/ars.2011.4145
9. Bianchi ML, Antunes LMG. Radicais livres e os principais antioxidantes da dieta. Rev Nutr, 1999; 12,(2):123-130. Doi: http://dx.doi.org/10.1590/S1415-52731999000200001
10. Yoshihara D, Fujiwara N, Ookawara T, Kato S, Sakiyama H, Yokoe S, Eguchi H, Suzuki K. Protective role of glutathione S-transferase A4 induced in copper/zinc-superoxide dismutase knockout mice. Free Radic Biol Med. 2009; 47:559-567. Doi: http://dx.doi.org/10.1016/j.freeradbiomed.2009.05.022
11. Alvarez CA, Moraes GV. Efeitos da selenometionina e vitamina c sobre o sêmen. SaBios: Revista de Saúde e Biologia. 2006; 1(1):42-51.
12. National Academies of Sciences, Engineering, and Medicine. 2016. Nutrient Requirements of Beef Cattle, Eighth Revised Edition. Washington, DC: The National Academies Press.
13. Van Soest PJ, Robertson JB, Lewis BA. Methods for dietary fiber, and nonstarch polysaccharides in relation to animal nutrition. J Dairy Sci. 1991; 74 (10): 3583-3597. Doi: http://dx.doi.org/10.3168/jds.S0022-0302(91)78551-2
14. Silva DJ, Queiroz AC. Análise de alimentos: métodos químicos e biológicos. 3.ed. Viçosa, MG: Universidade Federal de Viçosa, 2002. 165p.
15. Suttle, NF. Mineral Nutrition of livestock, 4.ed. Oxfordshire, UK: Cabi, 2010. 579p.
16. CBRA. Colégio Brasileiro de Reprodução Animal. Manual para exame andrológico e avaliação de sêmen animal. 3. ed. Belo Horizonte, 2013.
17. Jeyendran RS, Van der vem HH, Perez-Pelaez M, Gravo BG, Zaneveld LJD. Development of an assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characteristics. J Reprod Fertil. 1984; 70(1): 219-228.
18. Harayama H, Kusunoki H, Kato S. Capacity of goat epididymal spermatozoa to undergo the acrosome reaction and subsequent fusion with the egg plasma membrane. Reprod Fertil Dev.1993; 5(3):239-246.
19. Rota A, Strom B, Linde-Forseberg C. Effects of seminal plasma and three extenders on canine semen stored at 4 ºC. Theriogenology, 1995; 44:885-900.
20. Beconi MT, Affranchino MA, Schang LM, Beorlegui NB. Influence of antioxidants on SOD activity in bovine sperm. Biochem Int. 1991; 23(3):545-553.
21. SAS. 2001. The statistical analyse system for windows: version 8. Cary, 1999-2001. CD-Rom.
22. Sergerson EC, Johnson BH. Selenium and reproductive function in yearling Angus bulls. J Anim Sci. 1980; 51:395-401.
23. Pasa C. Relação reprodução animal e os minerais. Rev Biod. 2010; 9(1): 101 -122.
24. Bartle JL, Senger PL, Hillers JK. Influence of injected selenium in dairy bulls on blood and semen selenium, glutathione peroxidase and seminal quality. Biol Reprod. 1980; 23:1007-1013.
25. Ahsan U, Kamran Z, Raza I, Ahmad S, Babar W, Riaz MH, Iqbal Z. Role of selenium in male reproduction—A review
. Anim Reprod Sci. 2014; 146: 55–62. Doi: http://dx.doi.org/10.1016/j.anireprosci.2014.01.009
26. Marai IFM, El-Darawany AA, Ismail EA, Abdel-Hafez MAM. Reproductive and physiological traits of Egyptian Suffolk rams as affected by selenium dietary supplementation and housing heat radi- ation effects during winter of the sub-tropical environment of Egypt. Arch. Tierz. 2009; 52: 402–409. Doi: http://dx.doi.org/10.1016/j.anireprosci.2014.01.009
27. Domosławska A, Zdunczyk S, Franczyk M, Kankofer M, Janowski T. Selenium and vitamin E supplementation enhances the antioxidant status of spermatozoa and improves semen quality in male dogs with lowered fertility. Andrologia. 2018;e13023. Doi: http://dx.doi.org/10.1111/and.13023
28. Spallholz JE. Free radical generation by selenium compounds and their prooxidant toxicity. Biomed Envirom Sci. 1997; 10:260-270.