EFEITOS DO EXTRATO DE PAREDE DE LEVEDURA EM DIETA SECA SOBRE A
MICROBIOLOGIA, ÁCIDOS GRAXOS DE CADEIA CURTA E REDUÇÃO DO ODOR DAS FEZES DE
GATOS ADULTOS
Adriana
Augusto Aquino1, Mariana Pereira Alves2, João Paulo
Fernandes Santos3, Marcus Antônio Rossi Feliciano4,
Roberta Hilsdorf Piccoli5, Flávia Maria de Oliveira Borges Saad5
RESUMO
Objetivou-se
avaliar os efeitos do extrato de parede de levedura (EPL) em dieta seca sobre a
microbiota fecal, concentração de ácidos graxos de cadeia curta (AGCC) e
redução do odor das fezes de gatos adultos. Foram utilizados 20 animais, dez de
cada sexo, distribuídos ao acaso em quatro tratamentos e cinco repetições,
totalizando 20 unidades experimentais: 1) dieta comercial seca (controle); 2)
controle + 0,2%; 3) controle + 0,4%; e 4) controle + 0,6% de EPL na matéria
seca da dieta. Foram realizados contagem de enterobactérias, E.coli e bactérias láticas, concentração
fecal dos ácidos acético, propiônico, butírico e nitrogênio amoniacal, além de
painel sensorial. Não foram observadas diferenças significativas (p>0,05)
para as contagens bacterianas e a concentração de AGCC e nitrogênio amoniacal;
no entanto, por meio do painel sensorial pôde ser notada redução no odor das
fezes com o uso de 0,2% de EPL na dieta. Concluiu-se que a adição de até 0,6%
de EPL não teve efeito sobre a microbiologia e a concentração de ácidos graxos,
mas há potencial uso como aditivo devido à melhora no odor das fezes. Outros
estudos são necessários para compreender os mecanismos de ação, efeitos e
níveis de inclusão desse prebiótico para gatos domésticos.
--------------------------
EFFECTS OF
YEAST CELL WALL EXTRACT IN DRY DIET ON MICROBIOLOGY, SHORT-CHAIN FATTY ACIDS
AND FECAL ODOR REDUCTION OF ADULT CATS
The aim of this study was to evaluate the effects
of yeast cell wall extract (YCW) in dry diet on the fecal microbiota,
concentration of short-chain fatty acids (SCFA) and on the odor reduction of cats
feces. We used 20 animals of both sexes, randomly assigned to four treatments
and five repetitions totaling 20 experimental units: 1) dry commercial diet
(control); 2) control + 0.2%, 3) control + 0.4%, and 4) control + 0.6% of YCW
in dry matter. Enterobacteriaceae and lactic acid bacteria, fecal concentration
of acetic, propionic and butyric acids, ammonia nitrogen and sensory panel were
performed. There were no significant differences (p> 0.05) for bacterial
counts and the concentration of SCFA and ammonia, but in sensory panel a
reduction in the odor of feces could be noted with the use of 0.2% of YCW. We
concluded that the addition of up to 0.6% YCW had no effect on the microbiology
and the concentration of fatty acids, but there is potential for its use as an
additive because of the improvement in the odor of feces. However, further
studies are needed to understand the mechanisms of action and the effects of
prebiotics for domestic cats.
---------------------------
A parede celular da levedura Saccharomyces cerevisiae é constituída
por 35-40% de mananoproteínas, 5-10% de 1,6 beta-glucano, 50-55% de 1,3
beta-glucano e 1-2% de quitina (KLIS et al., 2002). O mananoligossacarídeo
(MOS) corresponde a quase 50% da fração carboidrato da parede e tem demonstrado
capacidade de modular a microbiota intestinal gerando benefícios decorrentes da
seleção bacteriana, tais como produção de ácidos graxos de cadeia curta e
redução de odor de fezes. Isso é importante porque os ácidos graxos, além da nutrição das células intestinais, causam alterações
do fluxo sanguíneo e da atividade muscular no cólon, proliferação de
enterócitos e estimulação da produção de mucina, o que melhora a saúde
intestinal (TELLEZ et al., 2006). Cabe comentar que são escassos os estudos
sobre os efeitos desses elementos em felinos.
A seleção de bactérias
benéficas promovida pela utilização do MOS, em detrimento de populações como
clostridios e enterobactérias, pode alterar a utilização de nutrientes pelos
microorganismos no intestino grosso e, assim, diminuir a produção de compostos
oriundos do metabolismo da proteína, o que pode reduzir o mau odor das fezes
(TORTORA et al., 2002). Espécies proteolíticas produzem compostos tóxicos ao
passo que os ácidos graxos de cadeia curta, oriundos do metabolismo de outras
espécies são interessantes por aumentar a produção de energia para o intestino
(WALKER & DUFFY, 1998).
O principal mecanismo por
meio do qual o mananoligossacarídeo modula a microbiota é tornando-se sítio de
ligação para determinadas bactérias gram-negativas, o que impede o acoplamento
destas à superfície das células intestinais. Isso acontece devido à
constituição particular desse grupo de bactérias que apresentam resíduos de D-manose em suas fímbrias. Patógenos com
fímbria tipo 1 manose-específica adsorvem o MOS prontamente e deixam o
intestino sem possibilidade de colonizá-lo (BASSAN et al., 2008). Dessa forma,
objetivou-se, por meio deste trabalho, avaliar o efeito de diferentes níveis de
extrato de parede de levedura (EPL) (0; 0,2; 0,4 e 0,6%) em dieta seca sobre a
contagem de bactérias láticas, enterobactérias e Escherichia coli, e concentração de ácidos graxos de cadeia curta.
O delineamento experimental
foi inteiramente casualizado, com quatro tratamentos e cinco repetições, totalizando
20 unidades experimentais. Foram destinados 21 dias de adaptação seguidos por
quatro de coleta de fezes frescas para análises de microbiologia (contagem
total de enterobactérias, Escherichia
coli e bactérias láticas), ácidos graxos de cadeia curta, nitrogênio
amoniacal e teste sensorial para avaliação do potencial de redução do odor das
fezes.
Os tratamentos fornecidos a
cada um dos grupos foram: (1) controle, dieta comercial seca padrão; (2) dieta
comercial seca + inclusão de 0,2% EPL; (3) dieta comercial seca padrão + 0,4%
EPL; e (4) 0,6% de EPL na matéria seca da dieta.
As quantidades de alimento
oferecidas foram baseadas nas necessidades energéticas estimadas pela equação
100 x PC0,67 (National
Research Council, 2006). Para
mistura da EPL, o escore corporal foi determinado no início e ao final do
período experimental e todos os animais apresentaram-se entre o escore 3,
considerado ideal para gatos, segundo a escala de 1 a 5. Quantidade padronizada
de água (1,92 vezes o peso da ração) foi acrescida e o alimento foi processado
em liquidificador. Posteriormente, a quantidade para cada animal foi
individualmente pesada e o EPL misturado. A composição química e básica
analisada da dieta seca foi de: 1) para matéria natural seca, obteve-se 7,17%
de umidade, 32.34% de proteína e 6,62% de matéria mineral; 2) para matéria
seca, verificou-se 34,83% proteína e 7,13% de matéria mineral.
Foi utilizada uma dieta comercial padrão para felinos adultos
com a seguinte composição: arroz quebrado, farinha de vísceras, farelo de
glúten de milho 60, milho integral moído, farelo de soja, farinha de peixe,
gordura de frango, carne de ovelha em pó, semente de linhaça, hidrolisado de
frango ou subprodutos, fosfato bicálcico, cloreto de sódio, cloreto de
potássio, colina e premix vitamínico mineral. As análises bromatológicas foram
realizadas no laboratório de pesquisa animal da Universidade Federal de
Lavras.
Foi determinada também a energia digestível para cada um dos
tratamentos (3769,61; 3623,29; 3825,18 e 3832,11 kcal/kg para controle e
inclusão de 0,2; 0,4 ou 0,6% de EPL, respectivamente) e, por meio das equações
propostas pelo NRC (2006), foi determinada a energia metabolizável corrigida
(3577,01; 3434,89; 3624,70 e 3624,19 kcal/kg para controle e inclusão de 0,2;
0,4 ou 0,6% de EPL, respectivamente).
A água oferecida aos animais
foi avaliada quanto a sua potabilidade, segundo a resolução número 518 de 2004
(Brasil, 2004). Tanto para água
como para o alimento foram coletadas amostras para análises de coliformes
totais e termotolerantes.
Para a análise das fezes,
realizou-se a contagem total de bactérias do ácido lático e enterobactérias,
usando-se ágar Man, Rogosa e Sharpe (MRS)/técnica de profundidade e ágar eosina
azul de metileno (EMB)/técnica de superfície, respectivamente. Todas as
análises microbiológicas seguiram metodologia descrita por SILVA et al. (2001).
Foram contadas as colônias maiores que 1mm, sendo os resultados
expressos em log de UFC/g de fezes. Em seguida, as colônias que cresceram nas
placas de ágar eosina azul de metileno (EMB) foram isoladas e plaqueadas para
testes confirmativos para E. coli. A
partir de culturas de colônias isoladas em PCA, fez-se a coloração de Gram e
inoculou-se nos meios teste para a realização das provas bioquímicas de indol,
VM (vermelho de metila), VP (Voges Proskauer) e citrato, na série denominada
IMViC. Foram consideradas positivas para E.
coli as colônias que se apresentaram como bastonetes gram negativos, indol
positivo ou negativo, VM positivo, VP negativo e citrato negativo.
As amostras de fezes coletadas até 15 minutos após a defecação foram conservadas em ácido clorídrico 2N e congeladas até o momento das análises que seguiu a metodologia da AOAC (1995). Após serem descongeladas, uma alíquota de 50 mL de cada uma das amostras foi transferida para o tubo de digestão onde realizou-se a destilação após a adição de 2mL de água destilada, 5mL de solução de cloreto de cálcio 5% e de algumas gotas de antiespumante. Recolheram-se cerca de 150 mL do destilado em erlenmeyer contendo 10mL de solução de ácido bórico 4% e cerca de 3 gotas da solução indicadora vermelho de metila e verde de bromocresol 2:1. A titulação foi realizada com ácido clorídrico 0,05 N e o teor de N-amoniacal calculado pela fórmula abaixo:
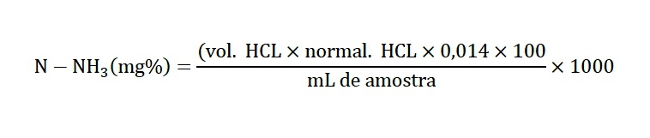
Cerca de
Um total de 51 pessoas
participou individualmente do teste e, entre as amostras, recebiam um copo de
pó de café, com o objetivo de eliminar os resíduos de odor referentes ao da
amostra anterior, que poderiam comprometer a avaliação sensorial. O teste foi
realizado no período da manhã (das 8 às 11) e teve duração de três horas. A
metodologia aplicada nesse teste sensorial foi adaptada do proposto por Maia (2010).
Para as análises de AGCC, segundo metodologia adaptada de ERWIN et
al. (1961), as fezes foram coletadas
até 15 minutos após a defecação, acidificadas com 10mL de ácido clorídrico a 2N
e congeladas até o momento das análises.
As mensurações dos ácidos acético, propiônico e butírico foram feitas a
partir do sobrenadante das alíquotas de fezes centrifugadas com ácido
metafosfórico 25%, em cromatógrafo de gás Shimadzu modelo 17A, equipado com
coluna nukol (30cm x 0,53mm). O nitrogênio foi o gás carreador, sendo a
temperatura inicial de
O cálculo para a concentração
de cada um dos ácidos presentes na amostra está demonstrado abaixo:

Em que: conc. = concentração
do padrão injetado; dens. = densidade do ácido; MS fezes= matéria seca das
fezes; MSD= matéria seca definitiva
O cultivo laboratorial das amostras de fezes
dos felinos
Notou-se maior
concentração das colônias 2, 3 e 4 em todos os animais estudados. As demais não
se apresentaram em proporções consideráveis ou estiveram relegadas a um único
tratamento, com exceção da colônia número 5 que esteve distribuída nos três
primeiros, mas ausente no tratamento de 0,6%. O baixo percentual de algumas das
colônias descritas nesse experimento pode ser devido à contaminação ambiental
ou mesmo expressão fenotípica diferenciada.
Sabe-se que, embora as
colônias bacterianas apresentem características específicas em um determinado
meio de cultura, condições de crescimento (como o tempo de desenvolvimento da
colônia, a interação/competição com outras bactérias, entre outros) podem
interferir decisivamente sobre a expressão destas (HOLT, 1997).
Das onze colônias
encontradas, três (as de número 1, 2 e 3) foram confirmadas como E. coli pelo teste de IMViC, associado à
coloração de Gram. Essas se apresentaram como bastonetes gram-negativos e
responderam negativamente ao citrato e ao Voges-Proskauer, mas positivamente ao
indol e o vermelho de metila.
A E.
coli representou 72,30% de todas as enterobactérias isoladas neste
experimento, correspondendo a 65,71%, 56,21%, 73,38% e 93,91% do total nos
tratamentos
Não houve diferença significativa
(p>0,05) para as contagens de Enterobacteriaceae, E. coli ou bactérias láticas, bem como para a relação entre
bactérias láticas e E.coli, conforme
demonstrado na Tabela 1.
O número de bactérias láticas
em log/g de fezes neste experimento esteve acima das concentrações citadas por
LEE et al. (2000), que indicam um número maior que 106 para
atividade probiótica.
Níveis de EPL semelhantes aos utilizados tem
sido efetivos em outras espécies de animais monogástricos, inclusive cães
(MIDDELBOS et al., 2007), para modular a microbiota intestinal a partir da ação
sobre a E. coli. No entanto, o
mecanismo de atuação do mananoligossacarídeo da parede da levedura é restrito
às bactérias fímbria tipo 1 e ainda não há relatos ou estudos que comprovem a
porcentagem dessas no intestino de felinos. Em frangos elas chegam a 68% do
total de bactérias intestinais da espécie (FINUCANE, 1999).
A ausência de efeito sobre a E.coli pode ter influenciado diretamente
o estabelecimento das bactérias láticas, devido à competição pela adesão. A
aderência eficiente das bactérias probióticas é dependente de uma relação mais
alta entre estas e E.coli (LEE et
al., 2002) e, no presente estudo, a relação manteve-se constante
independentemente dos tratamentos.
Efeitos das concentrações de EPL sobre a
contagem total de enterobactérias também não foram encontradas (p>0,05),
pois grande parte das bactérias que crescem
As médias para o escore de percepção de odor
(teste sensorial) das fezes e de nitrogênio amoniacal estão demonstradas na Tabela
2.
A concentração de nitrogênio amoniacal nas
fezes dos gatos foi semelhante independentemente dos tratamentos (p>0,05). É
importante considerar que a alta variabilidade do resultado de mensuração dessa
característica pode ter influenciado na ausência de diferenças estatísticas, já
que a concentração numérica no tratamento de 0,4% foi menos da metade da maior
concentração observada no tratamento de 0,2%. Essa característica corrobora os
resultados de mensuração dessas substâncias relatadas por SWANSON et al. (2002)
que creditaram esse acontecimento à baixa concentração desses metabólitos nas
fezes. Assim, em futuros experimentos um número maior de animais pode ser
necessário para avaliar com maior acurácia o teor fecal de nitrogênio
amoniacal.
Ressalta-se que os resultados encontrados
estão de acordo com os verificados por SWANSON et al. (2002), ao utilizarem
0,3% de mananoligossacarídeo em dietas para cães. Dietas para gatos possuem
naturalmente altos níveis de proteína (no presente estudo, 34% da matéria seca
da dieta) que, associada à particularidade dos felinos quanto ao metabolismo
proteico, poderiam ter contribuído para que diferenças maiores sobre a
concentração de nitrogênio amoniacal não fossem observadas. HESTA et al. (2003),
estudando frutoligossacarídeos, também observaram o mesmo efeito inibidor de
níveis elevados de proteína na dieta sobre a redução de amônia nas fezes de
cães.
Para o escore de redução de odor,
observou-se um ligeiro efeito positivo da inclusão de 0,2% de EPL na dieta. Os
voluntários atribuíram uma média de escore de 2,40 para as fezes provenientes
de animais do tratamento 2, o que a colocaria entre as classificações de igual
ao padrão e ligeiramente melhor que o padrão. Os tratamentos com 0,4 e 0,6% de
EPL também apresentaram escores ligeiramente superiores que as fezes dos
animais controle (2,04 e 2,10, respectivamente), no entanto, sem efeito
estatístico significativo (p>0,05). De forma inesperada, os voluntários
classificaram a amostra que apresenta numericamente o maior teor de nitrogênio
amoniacal como a que demonstrou o melhor potencial para a redução de odores.
O modelo sensorial desenvolvido por MAIA et al. (2010) foi
adaptado da análise sensorial de alimentos descritas por MORALES (1994) e
utilizado para mensurar os efeitos da Yucca
schidigera sobre a redução do odor de fezes de cães da raça Beagle. Esses
testes atribuem valores às amostras que são comparadas em relação ao padrão
(correspondente às fezes provenientes do tratamento controle). A escala varia
de 0 a 10 em que os números de 0 a 4 indicam amostras extremamente piores,
muito piores, regularmente piores ou ligeiramente piores que o padrão, 5 indica
amostras iguais ao padrão e de 6 a 10 amostras ligeiramente melhores,
regularmente melhores, muito melhores ou extremamente melhores,
respectivamente. Por esse motivo, pode haver subjetividade relacionada à
percepção sensorial e aos fatores ambientais, como presença de animais em casa,
inerentes a cada um dos avaliadores participantes da pesquisa. Apesar disso,
auxilia na avaliação da percepção do proprietário quanto à redução de odor e
pode ser aliado a métodos químicos (como a determinação de aminas biogênicas e
demais compostos) para um quadro mais completo dos efeitos de substâncias com
potencial de redução de odor. Trabalho semelhante ao de MAIA et al. (2010) foi
realizado em gatos por Roque et
al. (2011). Nessa metodologia procurou-se diminuir a escala de valores (de 0 a
4), facilitando dessa forma a classificação das amostras pelos avaliadores. Essa
foi a metodologia seguida neste trabalho.
Excluindo-se a subjetividade do teste sensorial, sugere-se que o
resultado encontrado pode ser atribuído a uma combinação de diversas
substâncias que, além dos compostos oriundos do metabolismo proteico (como
amônia, aminas biogênicas, indóis e outros), também incluem os ácidos graxos,
sendo que a junção de todos esses elementos é mais importante do que a presença
ou ausência de um componente isolado (LOWE et al., 1997)
No presente experimento, a concentração total de ácidos graxos
de cadeia curta, inclusive o acético, foi menor no tratamento de 0,2%, o que
pode ter contribuído para uma resposta positiva por parte dos examinadores.
Embora o limiar para a percepção de ácidos graxos (6,9 mg/L para o acético)
seja bem maior que para a amônia (1 μg/L) (LOWE et al., 1997), a dieta
comercial seca com inclusão de 0,2% EPL pode ter interferido positivamente
sobre a combinação das substâncias componentes do mau odor.
As concentrações totais médias de AGCC
encontram-se dentro dos padrões estabelecidos para felinos alimentados com
dietas comerciais que são normalmente inferiores a 600 mmol (Brosey et al., 2000). A proporção molar
média foi de 65,23% para o acético; 23,94% para o propiônico e 10, 82% para o
butírico, que são valores semelhantes aos descritos por SWANSON et al. (2002)
para cães. Nenhum efeito da inclusão de EPL na dieta foi encontrado sobre as
concentrações de AGCC, mas a proporção de ácido propiônico foi significativamente
alterada pela dieta. No entanto, o R2 foi baixo e não permitiu o
ajuste de equações de regressão. Esses resultados são contrastantes com os
observados em outras espécies. Em perus, por exemplo, a concentração de ácidos graxos totais foi
significativamente menor em animais alimentados com EPL por uma diminuição na
concentração de ácido propiônico (ZDUNCZYK et al., 2005).
Os resultados para a concentração de ácidos graxos de cadeia
curta (acético, propiônico e butírico) estão demonstrados na Tabela 3.
Os ácidos graxos de cadeia
curta são provenientes da fermentação bacteriana no cólon especialmente de
carboidratos e aminoácidos (COMMANE et al., 2005) e o ácido lático é um dos
principais produtos desse processo. A manutenção da população de bactérias
láticas bem como a não interferência sobre o número de E. coli pode ter contribuído para a obtenção de resultados
similares nas concentrações totais. A alteração na proporção molar de ácido
propiônico poderia ter sido decorrente da ação do mananoligossacarídeo da EPL
sobre espécies bacterianas propiônicas; no entanto, é importante considerar que
o coeficiente de determinação da equação foi baixo. Em humanos e cães, uma das
principais bactérias com essa característica são as bifidobactérias; entretanto,
em felinos, o seu isolamento é mais difícil e suas concentrações menores
(RASTALL et al., 2004). Um fator que poderia explicar esse resultado seria uma
melhor eficiência na conversão do ácido lático a AGCC nos tratamentos de 0,2 e
0,4% de EPL já que embora diferenças significativas não tenham sido
encontradas, o ácido butírico seguiu o mesmo padrão do propiônico. Assim,
estudos sobre a microbiota intestinal de felinos domésticos e o seu
comportamento na produção de ácidos graxos de cadeia curta são necessários e
poderão esclarecer esses pontos no futuro.
REFERÊNCIAS
ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS, I.
Official Methods of Analysis. Arlington, VA. 16 ed, 1995.
BASSAN, J.D.L.; FLÔRES, M.L.; ANTONIAZZI, T.;
BIANCHI, E.; KUTTEL, J.; TRINDADE, M.M. Controle
da infecção por Salmonella Enteritidis em frangos de corte com ácidos
orgânicos e mananoligossacarídeo. Ciência Rural, v.38, 1961-1965, 2008.
BRASIL. Portaria ANVISA nº 518, de 25 março de
2004, Estabelece os procedimentos e responsabilidades relativas ao controle e
vigilância da qualidade da água para o consumo humano e seu padrão de
potabilidade e dá outras providências. Portaria nº 518. Diário Oficial da República Federativa do Brasil. Brasília, DF, 26
março, 2004.
BROSEY, P.B; HILL, R.C; SCOTT, K.C. Gastrointestinal volatile fatty acid
concentrations and pH in cats. American Journal of Veterinary Research, v.
61, p. 359-361, 2000.
COMMANE, D; HUGHES , R; SHORTT, C; ROWLAND, I.
The potential mechanisms involved in the anti-carcinogenic action of
probiotics. Mutation Research, v.
591, p. 276–289, 2005.
ERWIN, E. S., MARCO, G. J; EMERY, E. M.
Volatile fatty acid analyses of blood and rumen fluid by gas chromatography.
Journal of Dairy Science, v. 44, p.
1768–1771, 1961
FINUCANE, M; SPRING,
P; NEWMAN, K. Incidence of mannose-sensitive adhesins in enteric bacteria. Poultry Science. v. 78, p. 139 (Abst), 1999.
GIBSON, G.R; PROBERT, H.M; VAN LOO, J; RASTALL,
R.A; ROBERFROID M.B. Dietary modulation
of the human colonic microbiota: updating the concept of prebiotics. Nutrition
Research Reviews. v. 17,
p. 259–275, 2004.
HESTA, M; ROOSEN, W;
JANSSENS, G.P.J; MILLET, S; WILDE, R. Prebiotics affect nutrient digestibility
but not faecal ammonia in dogs fed increased dietary protein levels. British
Journal of Nutrition, v.
90, p. 1007-1014, 2003.
HOLT, J.G et al. Bergey’s manual
of determinative bacteriology. Baltimore: Willians Wilkins, 9ª ed,1994. 787
p.
LAFLAMME D. “Development and validation of a
body condition score system for cats: A clinical tool. Feline Practice; v.25, p.13-18, 1997
LEE, K; LIM, C.Y; TENG, W. L; OUWEHAND, A.C;
TUOMOLA, E. M; SALMINEN, S. Quantitative approach in the study of adhesion of
lactic acid bacteria to intestinal cells and their competition with
enterobacteria. Applied and
Environmental Microbiology, v. 66, p. 3692-3697, 2000.
LOWE, J.A; KERSHAW, S.J. The ameliorating
effect of Yucca schidigera extract on
canine and feline faecal aroma. Research in Veterinary
Science, v.
63, p. 61-66, 1997.
MAIA,
G.V.C; SAAD, F. M. O. B.; ROQUE, N. C.; FRANÇA, J; LIMA, L.M.S; AQUINO, A. A.
Zeólitas e Yucca schidigera em rações para cães: palatabilidade,
digestibilidade e redução de odores fecais. Revista Brasileira de Zootecnia, v.39, p.2442 - 2444, 2010.
MIDDELBOS, I.S;
GODOY, M.R; FASTINGER, N.D; FAHEY, G.C.Jr. A dose-response evaluation of
spray-dried yeast cell wall supplementation of diets fed to adult dogs: Effects
on nutrient digestibility, immune indices, and fecal microbial populations.
Journal of Animal Science, v. 85, p. 3022-3032, 2007.
NATIONAL RESEARCH COUNCIL. Nutrient requirements of dogs and cats. Washington, D.C: National
Academy of Science, National Academy Press, 2006. 398 p.
RASTALL, R.A. Bacteria in the gut: friends and
foes and how to altere the balance. Journal of Nutrition, v. 134, p. 2022S–2026S, 2004.
ROQUE, N.C; SAAD, F.M.O.B; SANTOS, J.P.F;
EBINA, F.S; CHIZZOTTI, A.F; SILVA, R.C; AQUINO, A.A; MAIA, G.V.C. Increasing levels of zeolite and Yucca
schidigera in diets for adult cats. Revista Brasileira de
Zootecnia, v.40, p.2471-2475, 2011.
SAS
Institute Inc. SAS User’s guide: statistics.
Ver. 9.1.1, SAS Inst., Cary, NC, 2004.
SILVA,
N; JUNQUEIRA, V.C.A; SILVEIRA, N.F.A. Manual
de métodos de análises microbiológicas de alimentos. 2ª ed. São Paulo:
Varela, 2001. 295p.
SWANSON,K.S;GRIESHOP,C.M;
FLICKINGER, E.A; BAUER, L.L; HEALY, H.P; DAWSON, K.A; MERCHEN, N.R; FAHEY, G.C.
Jr. Supplemental frutooligossacharides and
mannanoligossaccharides influence immune function, ileal and total tract
nutrients digestibilities, microbial populations and concentrations of protein
catabolites in the large bowel of dogs.
Journal of Nutrition. v. 132, p. 980-989, 2002.
TELLEZ, G; HIGGINS, S.E; DONOGHUE, A.M; HARGIS,
B.M. Digestive physiology and the role of microorganisms. The Journal of Applied Poultry
Research, v.15, p. 136–144, 2006.
TORTORA, G.J; FUNKE, B.R; CASE, C.L. Microbiologia. 6ªed. Porto Alegre:
Artmed, 2002. 827 p.
WALKER, W.A; DUFFY, L.C. Diet and bacterial
colonization: Role of probiotics and prebiotics. The Journal of Nutrional Biochemistry, v. 9. p.668–675, 1998.
ZDUNCZYK, Z; JUSKIEWICZ, J; JANKOWSKI, J; BIEDRZYCKA, E; KONCICKI, A. Metabolic response of the gastrointestinal tract of turkeys to diets with different levels of mannan-oligosaccharide. Poultry Science, v. 84, p. 903-909, 2005.
Protocolado em: 17 ago. 2011. Aceito em 09 out. 2012.